Hovedartikler
International Year of Light 2015 and PDT (Photodynamic therapy)
Jan Folkvard Evensen. Avdeling for kreftbehandling. Klinikk for kreft, kirurgi og transplantasjon, Oslo universitetssykehus, Radiumhospitalet
Introduksjon

Jan Folkvard Evensen
År om annet tilegner UNESCO året en eller annen vitenskap/aktivitet. År 2005 ble tilegnet fysikk (World year of physics 2005). Man markerte da at det var 100 år siden Einsteins ”annus mirabilis”. I 1905 publiserte han tre arbeider som alle var gjennombrudd på hvert sitt område. Med teorien for Brownske bevegelser beviste han molekylenes eksistens. Med den spesielle relativitetsteori løste han en inkonsistens vedrørende Newtons gravitasjonsteori og Maxwell likninger for elektromagnetiske bølger. Teorien er basert på 2 postulater, nemlig 1.) at fysikkens lover er de samme for alle inertiale observatører (observatører som beveger seg rettlinjet med konstant hastighet, dvs. ikke påvirket av krefter, derav betegnelsen spesiell) og 2.) lyshastigheten i vakuum er den samme for alle observatører. Av dette kunne han bl.a. slutte at energi og masse er ekvivalente størrelser, jfr. E = mc2. Med teorien for lysets kvantenatur forklarte han den fotoelektriske effekt (jfr. fotoner). Det var for denne teorien han ble tildelt Nobelprisen i fysikk for 1921.
I 1915 publiserte Einstein den generelle relativitetsteori (100 års jubileum i år!), generell fordi den også omfatter observatører som er påvirket av krefter, dvs. observatører under akselerasjon, rettlinjet eller krum. Han introduserte med denne ekvivalens-prinsippet (“the happiest thought of my life”): det er ikke mulig å skille mellom inertiale krefter og gravitasjonskrefter, treg og tung masse er lik. Den generelle relativitetsteori er en gravitasjonsteori, hvor tyngdekraften fremkommer som geometri (”gravity becomes geometry”). Dette var en tankekonstruksjon uten sidestykke. Newtons gravitasjonsteori er dog fortsatt gangbar og kan sees på som en approksimasjon av Einsteins teori for ikke-relativistiske hastigheter. Man kan reise tur retur månen med Newtons gravitasjonsteori.
Året 2009 ble dedikert astronomi (International year of astronomy 2009), 2013 matematikk (Mαthematics of Planet Earth 2013) og 2014 krystallografi (International year of crystallography 2014). Den 20. desember 2013 proklamerte FN’s generalforsamling år 2015 som International Year of Light and Light-based Technologies (IYL 2015), Fig. 1. Med det har FN anerkjent at verden trenger å bli mer oppmerksom på hvordan lys-baserte teknikker fremmer bærekraftig utvikling og representerer løsninger på globale utfordringer innen energi, utdanning, jordbruk og helse. Lys er vitalt i dagliglivet, og samtidig en nødvendig tverrfaglig disiplin innen naturvitenskap i det 21. århundre. Lys har revolusjonert medisinen, har åpnet internasjonal kommunikasjon over Internet, og er sentral i å samle kloden til et samfunn, på kulturelt, økonomisk og politisk vis (1).
Jeg synes dette er en passende anledning til å se på den medisinske anvendelse av lys generelt, PDT spesielt. Viktigheten av lys kom for øvrig til uttrykk gjennom tildeling av Nobelprisen i fysikk 2014 til Akasaki, Amano og Nakamura: ”for the invention of efficient blue light-emitting diodes which has enabled bright and energy-saving white light sources”. Lysdioder (LED) er halvledere som avgir lys når elektrisk strøm passerer gjennom dem. LED-lys er strømbesparende, varer lengre og er dermed mer miljøvennlig. LED er fremtidens lyskilde.
Apropos viktige lyskilder: Etter at Einstein hadde ferdigstilt relativitetsteorien rettet han oppmerksomheten mot vekselvirkningen mellom stråling og materie og hvordan disse kunne komme i termisk likevekt. Han forbedret da den statistiske teori for varme ved å ta hensyn til at energien er kvantisert. Einstein foreslo først at et eksitert atom kunne returnere til lavere energinivåer ved å avgi fotoner, en prosess han kalte spontan emisjon. Teorien predikerte videre at lys som passerer et eksitert system kunne stimulere til emisjon av mer lys, en prosess han kalte stimulert emisjon. Sannsynligheten for nevnte prosesser er gitt ved de såkalt Einstein koeffisienter. Einsteins ”1917-paper”, The Quantum Theory of Radiation, la grunnlaget for en svært viktig lyskilde, nemlig LASER (Light Amplification by Stimulated Emission of Radiation). Det var Charles Hard Townes (1915-2015) som videreutviklet teorien og omsatte den i praksis ved i 1954 å bygge en MASER (Microwave Amplification by Stimulated Emission of Radiation). Theodor Harold Maiman (1927-2007) forbedret maserens design og yteevne og endte opp med å konstruere en LASER. Rubinlaseren så dagens lys 16. Mai 1960. I dag finnes det utallige varianter og bruksområder av laser. Lys fra en laser er monokromatisk, koherent og kollimert (lite divergens). Sist nevnte egenskaper muliggjør skarp fokusering, noe som kommer til anvendelse i industrien så vel som i medisin. I medisinen finner vi den i kirurgien, oftalmologien og dermatologien.
Hva er lys? Rent kvalitativt er lys elektromagnetisk stråling. I 1861-62 publiserte James Clerk Maxwell (1831-1879) 4 likninger som beskriver hvordan elektriske og magnetiske felt forholder seg til hverandre. Han viste at et varierende elektrisk felt induserer et perpendikulært varierende magnetisk felt, og vice versa, og at de to danner et elektromagnetisk felt som brer seg som transverse bølger. Han beregnet hastigheten til slike bølger i vakuum og fant at denne stemte med godt overens med Armand Hippolyte Louis Fizeaus (1819-1896) målinger av lyshastigheten. Maxwell konkluderte med at lys brer seg som elektromagnetisk stråling.
Avhengig av hvilke fenomener man skal forklare kan lys sees på som bølgebevegelse eller partikler (fotoner). Det kalles komplementaritetsprinsippet og ble introdusert av Niels D Bohr (1885-1962) i 1928. Rent kvantitativt kan man definere synlig lys (det som øyet er i stand til å oppfatte) som elektromagnetiske bølger i bølgelengdeområde 380-750 nm. I det følgende vil jeg også omtale ultrafiolett lys, lys i bølgelengde-område 200-380 nm (UV A, B og C), lys som øyet ikke er i stand til å oppfatte.
Bruk av lys i medisinsk sammenheng har lange tradisjoner. Så tidlig som for 3000 år siden ga man ”pasienter” med vitiligo ekstrakt fra planter. Påfølgende eksponering for sollys resulterte i rask pigmentering av de lyse hudområder. Vi vet nå at plante-ekstraktene inneholdt psoralener.
I 1903 fikk Niels Ryberg Finsen (1860-1904) Nobelprisen i fysiologi eller medisin for sitt arbeid med lysbehandling av lupus vulgaris (hud tuberkulose). Han brukte UV-lys fra solen og fra buelamper. Finseninstituttet var Danmarks ”Radiumhospital”inntil 1981. Det ble da lagt inn under Rigshospitalet i København.
I 1956 observerte en observant sykepleier (J Ward) at nyfødte barn med gulsott ble mindre gule når de ble eksponert for sollys. Med dette som bakgrunn utførte RJ Cremer et eksperiment hvor han eksponerte 13 barn med gulsott vekselvis for 15-20 minutters sollys og skygge. Etter en periode på 2-4 timer ble deres bilirubinkonsentrasjon i blod redusert fra 10-25 mg/dl til 2-12 mg/dl. Denne observasjon er grunnlaget for lysbehandling av hyperbilirubinemi hos nyfødte. Ved å anvende lys i bølge-lengdeområdet 460-490 nm (blått lys) dannes isomere av bilirubin som er mer vannløselig og derved lettere å utskille i urin.
I 1970 introduserte JA Parrish PUVA behandling av psoriasis. Ved PUVA behandling inntas psoralen (8-methoxypsoralen) med påfølgende eksponering for UV-A (320-400 nm). Psoralen interkalerer i DNA og ved eksponering for UV-A stråling dannes kovalente bindinger mellom nærliggende pyrimidinbaser i DNA, med påfølgende apoptose. Behandlingen er meget effektiv, men psoralen er et mutagen og en bivirkning av behandlingen er uheldigvis hudkreft, fortrinnsvis plateepitelkarsinom, men også malignt melanom. PUVA behandling for psoriasis er nå langt på vei erstattet med TL01 behandling hvor man bruker smalspektret UVB lys (311-313 nm). PUVA behandling er også forsøkt mot mycosis fungoides (H Honigsmann 1984).
PDT
Forløperen til fotodynamisk behandling (PDT) går tilbake til 1900. Da oppdaget Raab at acridin var toksisk for paramecia (éncellet protozo), men bare ved eksponering for sollys. I 1903 forsøker Tappenier og Jesionek å behandle hudtumores med eosin og sollys. I 1913 demonstrerer Meyer-Betz fotosensibiliserende effekt av porfyriner ved å injisere hematoporfyrin iv. på seg selv. Den første rapport om fluorescens i svulster etter iv. injeksjon av porfyrin kom i 1942 (Auler & Banzer) og den første rapport om behandling av kreft med HpD (hematoporfyrin derivative) i 1966 (Lipson). Dougherty og medarbeidere ved Roswell Park Memorial Institute var de som for alvor startet systematisk utprøving av PDT ved cutane og subcutane svulster i 1974. For referanser, se (2).
I Norge var det professor Johan Moan (Fig. 2) ved Norsk Hydros Institutt for Kreftforskning som først fattet interesse for PDT. Det var så tidlig som i 1972-73. Moan ble raskt en av verdens ledende på dette området og knyttet til seg mange stipendiater, mest realister, men også noen leger, bl.a. undertegnede.
Anvendelse av porfyriner i diagnostikk og behandling av kreft er tuftet på 3 egenskaper: 1) porfyriner retineres i høyere grad i neoplastisk vev enn de fleste normale vev, 2) porfyriner fluoriserer og 3) porfyriner er fototoksiske, dvs. cytotoksiske når de aktiveres med lys.
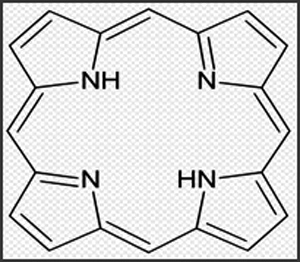
Figur 3. Porfyrin-molekylet.
Porfyriner: kjemiske og fysiske egenskaper
Porfyrin består av fire pyrrol ringer bundet sammen til et plant molekyl ved hjelp av methylenbroer (Fig. 3). Porfyriner har lett for å danne komplekser med metall-ioner. Kompleksering med jern, magnesium og kobolt gir h.h.v. heme, klorofyll og kobalamin (B12-vitamin). Porfyrinenes fotosensibiliserende effekt svekkes ved kompleksering med metaller. Mest effektive i så måte er frie porfyriner.
Porfyriner absorberer lys i UV- såvel som det synlige område. UV-båndet (Soret-bånd: 360-400 nm) er intenst og oppkalt etter oppdageren Jacques-Louis Soret (1827-1890). Det er noen mindre intense bånd i området 500-700 nm (Q-bånd). Selv om de er svakere så er de viktige ved at de ligger i et område hvor lys har en fordelaktig vevtransmisjon (Fig. 4).
I 1924 introduserte Wolfgang Pauli (1900-1958) en ny kvantemekanisk frihetsgrad for å forklare uoverensstemmelse mellom molekylære spektra og kvanteteori, der man forventet én spektrallinje fant man to. Året etter tolker SA Goudsmit (1902-1978) og G Uhlenbeck (1900-1988) den ekstra frihetsgrad ved å tillegge elektronet spinn, de så på elektronet som en elektrisk ladet kule som roterte. Pga. ladningen og det angulære moment oppfører elektronet seg som en liten stavmagnet. Som andre variable i mikrokosmos er elektronets spinn kvantisert, dvs. det kan bare innta to retninger i et magnetfelt, parallelt eller antiparallelt. Forskjellen i energi er avhengig av magnetfeltets styrke. I 1928 løser PAM Dirac (1902-1984) elektronets relativistiske Schrødingerlikning. Løsningen bidro til å forklare elektronets spinn som et relativistisk fenomen, men Goudsmit og Uhlenbecks tolkning er til alle ”praktiske” formål den greieste. Det gjelder også for MRI og kjernemagnetisk resonans.
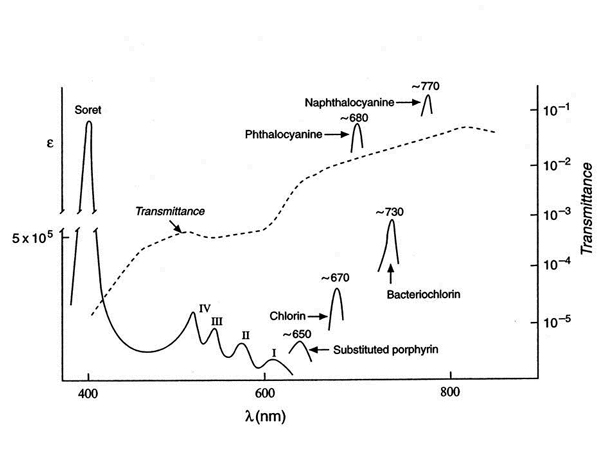
Figur 4. Relativ lystransmisjon i vev overlagret absorpsjonsspekter for porfyrin og andre fotosensitizere som funksjon av bølgelengde.
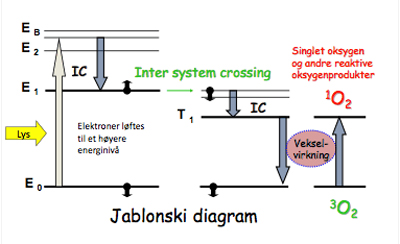
Absorpsjon av UV- eller synlig lys skjer ved at et elektron løftes til en uokkupert orbital med høyere energi, enten med bibeholdt eller endret spinn. Hvis spinnet bibeholdes kalles det en eksitert singlet, i motsatt fall eksitert triplett. Disse tilstandene er ustabile og vil tendere til å vende tilbake til grunntilstanden. Overskuddsenergien kan avgis med emisjon av lys, fluorescens fra eksitert singlet og fosforescens fra eksitert triplett. Fluorescens er grunnlaget for diagnostisk bruk av porfyriner. Evt. kan overskuddsenergien avgis til andre frihetsgrader, for eksempel vibrasjon, det kalles ”internal conversion” (IC) (Fig. 5).
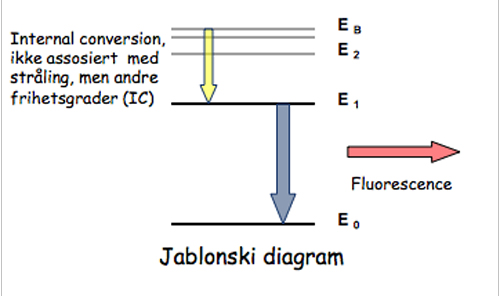
Figur 5. Jablonski diagram for fluorescens.
Endelig kan et eksitert molekyl avgi energi ved en fotokjemisk reaksjon. I Type I reaksjon reagerer det fotosensibiliserende molekyl direkte med det biologiske target molekyl. PUVA behandling er eksempel på dette. I en Type II reaksjon vil det fotosensibiliserende molekyl først delvis de-eksiteres ved IC, deretter gjennomgå ”inter system crossing”, hvilket innebærer at spinnet flipper og det dannes en triplett tilstand. Etter ytterligere IC overfører tripletten energi til oksygenets grunntilstand 3O2 og det dannes singlet oksygen 1O2 (Fig. 6). Denne formen for oksygen er mye mer elektrofil enn grunntilstanden (3O2) og reagerer med biomolekyler ved oksidasjon. Det er dette som skjer ved PDT og enkelte fototoksiske hudreaksjoner. På cellulært nivå resulterer dette vesentlig i membranskade.
Porfyrin transport og tumor lokalisering
Porfyriner gis vanligvis intravenøst. Man kjenner til flere porfyrinbindende proteiner i blod, først og fremst albumin og hemopexin. Så sent som i 1984 fant man imidlertid ut at lipoproteiner i høy grad binder hematoporphyrin og protoporfyrin. Selv om lipoprotein konsentrasjonen i blod bare utgjør 1-5 % av albumin konsentrasjonen fantes hele 50 % av porfyrinene i lipoprotein-fraksjonen. Dette er interessant mtp. LDL-reseptorer. Hurtigprolifererende kreftceller har høyere aktivitet av LDL-reseptorer enn normale celler. Man ser da for seg at porfyriner bundet til LDL følger med disse inn i cellen. Således korrelerer fordelingsmønsteret av HpD med det relative antall LDL-reseptorer i forskjellig vev.
En annen mulig forklaring på selektiv retensjon av porfyriner i tumorvev er tumorvevets lave pH, dvs. overskudd av protoner. Porfyrinene er vanligvis negativt ladet og nøytralisering med protoner gjør at de lettere trenger gjennom cellemembranen.
Vevsvolum er en sum av vaskulært-, interstitielt- og intracellulært volum. For normalt vev utgjør de to først nevnte hver ca. 20 %. I tumorvev utgjør det vaskulære volum bare 5 %, mens det interstitielle volum utgjør hele 50 %. Det interstitielle rom i tumores består i stor grad av kollagen og elastiske fibre. Det er kjent at porfyriner har en høy affinitet for nysyntetisert kollagen, dette sammen med en lekk karseng og insuffisient lymfedrenasje kan bidra til profyrinenes selektive retensjon i tumorvev.
Som konklusjon, det finnes ingen enkel forklaring på hvorfor porfyriner retineres i tumorvev. Alt tyder på at det er flere mekanismer som opererer sammen, hvorav enkelte kanskje ikke er kjent.
ALA-PDT
Heme er protoporfyrin IX med jern (Fe2+) bundet sentralt i tetrapyrolringen. Alle vev i organismen syntetiserer heme etter behov. Syntesen foregår dels intramitokondrielt, dels ekstramitokondrielt. Første trinn i syntesen er en reaksjon mellom succinyl(ravsyre)-Co A og glysin til δ-aminolevulinat (δ-ALA). Deretter følger en del mellomtrinn til sluttproduktet protoporfyrin IX. Ved hjelp av ferrochelatase inkorporeres jern med heme som resultat.
På begynnelsen av 80-tallet fikk Moan ideen om å teste cellulært opptak av fluorescin versus fluorescin di-acetat. Han fant at estere var svært viktig for å få molekyler inn i cellene. Han begynte så å arbeide med ALA-PDT og fant at forestring av ALA gjorde det lettere å få det inn i cellene. Inne i cellene starter syntesen av protoporfyrin IX. I kreftvev er genet for ferrochelatase nedregulert. Dette sammen med begrenset tilgang på jern gir en opphopning av protoporfyrin IX. Dette arbeid var grunnlaget for patentering av ALA-estere, fra C1 til C6. Patentet var grunnlaget for firmaet PhotoCure. Methylester-ALA (C1) fikk navnet Metvix® og hexylester-ALA (C6) Hexvix®. Førstnevnte brukes i behandling av aktinisk keratose (AK) og hudkreft, sistnevnte til diagnostikk av blærecancer.
ALA-PDT utføres ved at lesjonene prepareres ved curretage, hvoretter Metvix® krem påføres under en okkluderende bandasje. Etter 3 timer fjernes kremen og lesjonen belyses med rødt lys. Innledningsvis benyttet man laser. Laseren er nå erstattet av LED lamper som gir lys med bølgelengdetopp 630 nm (F.eks. Aktilite® CL 128). Man bruker rødt lys fordi det transmitteres best i vev (Fig. 4 og Fig. 7).
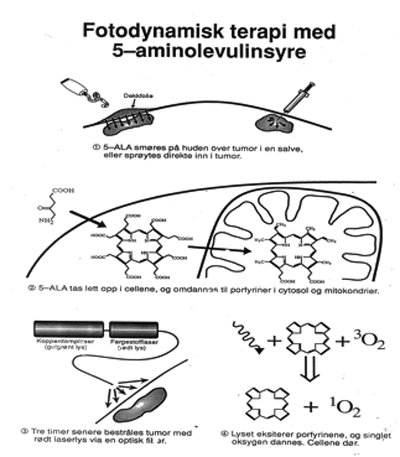
Figur 7. Topikal applikasjon av 5-ALA.
Aktinisk keratose
PDT er meget effektivt ved aktinisk keratose (AK). AK er den mest vanlige keratinocytt deriverte prekankrøse lesjon hos menneske og skyldes UV eksponering over tid. Det histologiske bilde ved AK er dysplasi med atypiske kjerner som er store, irregulære og hyperkromatiske. Dysplasien graderes i 3 nivåer, fra KIN I (keratinocytisk intraepidermal neoplasi I) til KIN III. KIN III er ekvivalet med carcinoma in situ (CIS)
Mekanismen for genomisk instabilitet i keratinocytter er høyst sannsynlig UV indusert inaktivering av p53. p53 mutasjoner er påvist i en signifikant prosentandel
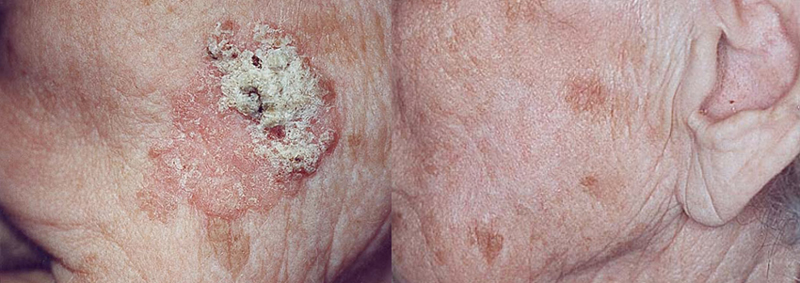
(>90 %) av plateepitelkarsinomer i hud. Samme mutasjoner finnes i AK (3). AK progredierer til plateepitelkarsinom med en estimert rate på 0.025 til 16 % per lesjon per år. I gjennomsnitt har pasienter 6 til 8 lesjoner. En pasient med flere AK har en årlig risiko for å utvikle plateepitelkarsinom på 0.15 til 80 % (4). Figur 8 viser resultat av PDT ved AK før og etter.

Figur 8. PDT av aktinisk keratose (før og etter).
BCC
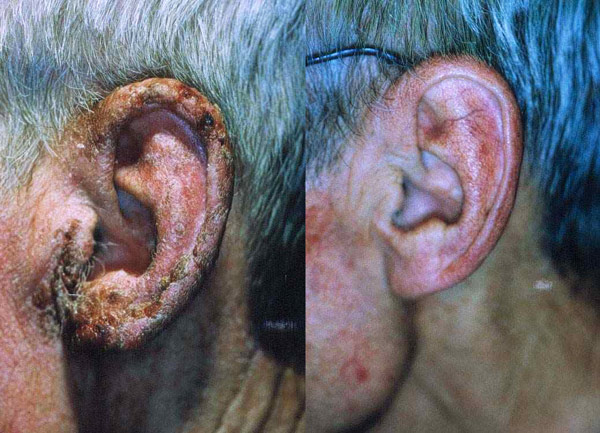
Basalcellekarsinom (BCC) er den vanligste form for hudkreft og skyldes også UV eksponering over tid. For alle praktiske formål kan man dele dem i 3 grupper: overflatiske, infiltrerende (mikronodulære og morpheaforme) og nodulære. Av disse er det de overflatiske som egner seg best for PDT, særlig de tynne og multiple. Responsraten er høy (>90 %) og det kosmetiske resultat utmerket. De infiltrerende kan være vanskeligere å behandle og de morpheaforme egner seg ikke til PDT. Ved grundig enukleasjon av nodulære BCC kan PDT være egnet. Figur 9 viser resultat av PDT ved BCC før og etter.
Bowens disease
PDT kan forsøkes ved Bowens disease (plateepitelkarsinom in situ) hvor kirurgi er mindre egnet.
Ved Radiumhospitalet har vi utført PDT siden begynnelsen av 90-tallet. I 2012 behandlet vi 805 pasienter hvorav 115 nyhenviste. Antall lesjoner behandlet var 3233 (AK + BCC).
Referanser
- http://www.mn.uio.no/fysikk/personer/vit/aas/lysaret-2015/om-lysets-ar-2015.html
- Evensen JF: The use of porphyrins and non-ionizing radiation for treatment of cancer. Acta Oncologica 1995; 34: 1103-1110
- Ziegler A et al.: Sunburn and p53 in the onset of skin cancer. Nature 1994; 372: 773-776
- Ratushny V et al.: From keratinocyte to cancer: the pathogenesis and modeling of cutaneous squamous cell carcinoma. The Journal of Clinical Investigation 2012; 122. 464-472