Klinikk
Rapport fra det første året med CAR T-celle terapi ved Radiumhospitalet
Marianne Brodtkorb, Overlege, Avdeling for kreftbehandling Oslo Universitetssykehus
Bente Loftum Wold, Overlege, Avdeling for kreftbehandling Oslo Universitetssykehus
Alexander Fosså, Overlege, Avdeling for kreftbehandling Oslo Universitetssykehus
Macarena Irarrazabal, Sykepleier, Avd for kreftbehandling A8, Koordinator for HMAS og CAR T
Ingunn Holumsnes Sandven, Sykepleier, Avd for kreftbehandling A8, Koordinator for HMAS og CAR T
Jon Riise, Overlege, Avdeling for kreftbehandling Oslo Universitetssykehus
Den 18. oktober 2022 besluttet Nye Metoder at behandling med kimær antigenreseptor (CAR) T-celle terapi kunne tas i bruk i Norge ved residivert eller refraktært diffust storcellet B-cellelymfom (r/r DLBCL) etter to eller flere linjer med systemisk behandling. Her følger noen av de erfaringene vi har gjort ved seksjon for lymfom og indremedisin ved Radiumhospitalet gjennom dette første året med CAR T-celle terapi
Bakgrunn
Siden de første pasientene med maligne blodsykdommer og lymfomer fikk CAR T-celle terapi for omtrent 15 år siden har det vært knyttet store forventninger til innføringen av denne banebrytende behandlingen. Det første barnet i verden som fikk behandling med CAR T-celler var syv år gamle Emily Whitehead ved Childrens Hospital i Philadelphia. Hun var i 2012 alvorlig syk med tilbakefall av akutt B-lymfoblastisk leukemi og er frisk i dag, 11 år senere. Siden 2012 har utviklingen av CAR T-celle terapi kommet langt og får stor oppmerksomhet i litteraturen og på de store konferansene innen maligne blodsykdommer og lymfomer.
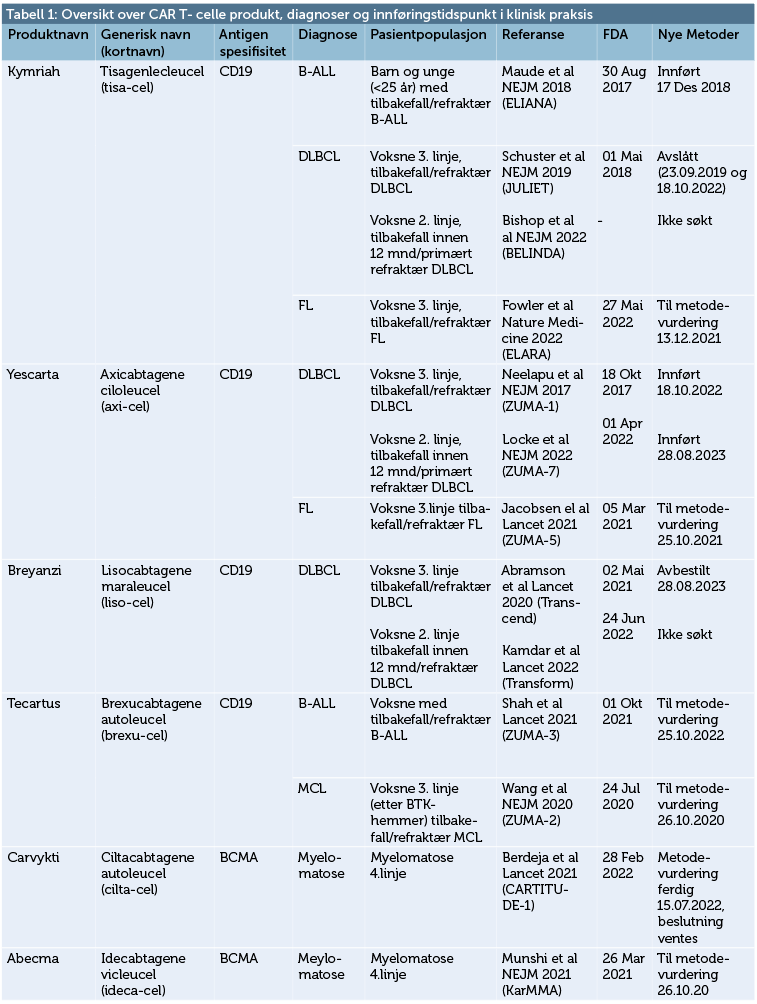
Det skulle gå ti år fra Emily Whitehead til Nye Metoder godkjente Axicabtagen ciloleucel (Yescarta®) fra Kite Gilead i oktober 2022, under forutsetning av at behandlingen skulle gis ved Oslo Universitetssykehus (OUS). Bakgrunnen for innføringen av behandlingen var ZUMA-1 studien, en fase-2 studie som ble publisert 5 år tidligere, i 2017. Yescarta er ett av seks CAR T-celle produkter som er godkjent av Food and Drug Administration (FDA) og European Medicinal Agency (EMA). Fire av disse produktene har indikasjoner ved undergrupper av leukemier og non-Hodgkins lymfomer og to ved myelomatose (tabell 1).
Seksjon for lymfom og indremedisin ved Radiumhospitalet hadde på forhånd erfaringer med CAR T-celle terapi til pasienter med r/r DLBCL gjennom deltagelse i tre kliniske studier med Tisagenlecleucel (Kymriah®) fra Novartis i perioden 2015-2021. På bakgrunn av dette fikk seksjonen i oppdrag å etablere et nasjonalt behandlingstilbud. Vi som forfattere av denne artikkelen var sentrale i dette arbeidet og ønsker på vegne av alle som har vært involvert å rapportere om prosessen og foreløpige resultater.
Innføring av CAR T-celle terapi
Da godkjenningen av CAR T-celle behandling for denne pasientgruppen kom en god del senere enn i andre land, opplevde både fagmiljøet og pasienter at arbeidet hastet. Innføringen av en ny og kompleks behandlingsmodalitet skulle foregå innenfor eksisterende budsjettramme. I løpet av de to siste månedene av 2022 la avdelingen og seksjonen derfor ned en betydelig innsats for å etablere nødvendige rutiner og prosedyrer. Disse omfattet rutiner for henvisning, pasientutredning, logistikk, kvalitetssikring av T-cellehøsting, forsendelse og mottak av ferdig CAR T-celle produkt, forberedelse av pasientene, infusjon av CAR T-celler, monitorering av pasienter etter infusjon og håndtering av bivirkninger. Vi etablerte samarbeidsrutiner med andre avdelinger på sykehuset, som avdeling for celleterapi og spesialistgrupper med støttefunksjoner innen anestesi og nevrologi. Vi underviste sykepleiere og leger ved onkologisk-, anestesiologisk- og nevrologisk avdeling ved OUS, i tillegg til fagpersonell på henvisende sykehus. For å sikre tilgang til denne nye behandlingen for alle landets pasienter, etablerte vi også ukentlig multi-disiplinært team (MDT) -møte på Norsk Helsenett hvor de fagansvarlige for lymfom-pasienter ved alle de fire regionsykehusene og andre henvisende sykehus deltar.
Det første MDT-møtet gikk av stabelen i starten av desember 2022. Første pasient fikk høstet T-celler midt i desember samme år og mottok Yescarta i begynnelsen av januar 2023. Vi ser nå tilbake på ett år med CAR T-celle terapi i rutinen.
Hva er CAR T-celle terapi?
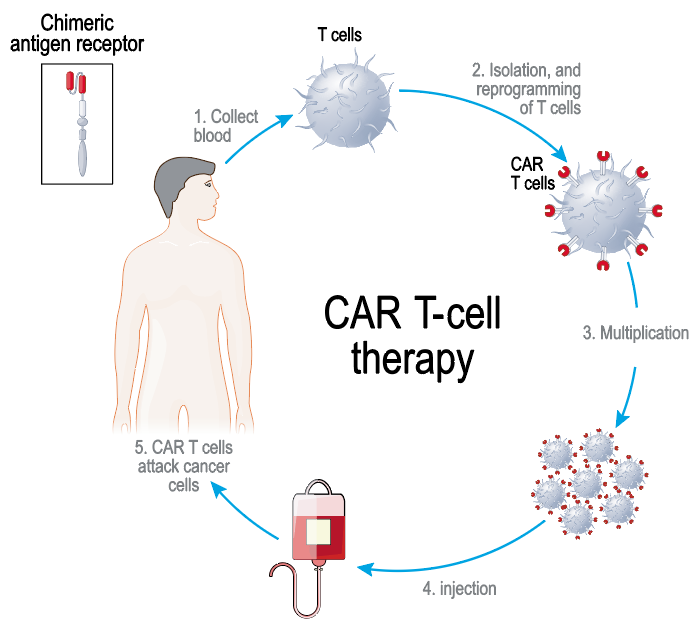
Ved CAR T-celle terapi utstyres pasientens egne T-celler med en ny, kunstig reseptor som er rettet mot et overflatemolekyl på kreftceller (tumor antigen). Den kunstige reseptoren kalles CAR (fra engelsk chimeric antigen receptor) fordi den er sammensatt av flere deler med ulik opprinnelse. Den indre delen representerer den intracellulære delen av T-celle reseptoren som genererer T-cellens aktiveringssignal. Den ytre delen stammer fra et antistoff og kan binde seg til tumor antigener. I tillegg består CAR av et såkalt kostimulatorisk domene som blant annet skal sørge for at de genmodifiserte T-cellene kan proliferere bedre og overleve lengre i pasienten. Det første trinnet i CAR T-celle terapi er høsting av pasientens egne T-celler fra perifert blod (såkalt leukaferese). Det syntetiske genet som koder for en CAR føres inn i pasientens T-celler ved hjelp av en virusvektor. CAR-genet blir dermed inkorporert i T-cellenes DNA, og den nye reseptoren kommer til uttrykk på T-cellenes overflate. Pasientens T-celler er da forvandlet til CAR T-celler som kan gjenkjenne og binde seg til tumorantigenet på kreftcellene. Ved hjelp av CAR tvinges T-cellene til å binde seg til kreftceller uavhengig av T-cellens egen reseptor og tumorcellens eventuelle vevsantigener av typen «major histocompatibility antigen» (MHC)-klasse I og klasse II molekyler. Det spiller ingen rolle om kreftcellene har sluttet å presentere peptidantigener på MHC for å unnvike immunforsvaret, den kunstige reseptoren er designet for å gjenkjenne og binde seg til et annet (og gjerne kreftspesifikt) molekyl på kreftcellen. Ved denne bindingen kommer CAR T-cellene i tett kontakt med kreftcellene og aktiveres til målrettet og spesifikt drap av kreftcellene. Produksjonen av CAR T-celler inkluderer også en ekspansjonsprosess der cellene mangfoldiggjøres i kultur utenfor pasienten. Slik det gjøres i dag blir cellene frosset etter ferdig produksjon og sendt tilbake fra produsent til sykehuset. De siste dagene før CAR T-celleinfusjonen får pasienten en cellegift kur, enten en kombinasjon av fludarabin og cyklofosfamid eller bare bendamustin. Begge disse kurene er spesielt lymfotoksiske og medfører lymfopeni, og kuren kalles derfor lymfodeplesjon. Hensikten er å sette i gang en produksjon av cytokiner som kan stimulere til proliferasjon av lymfocytter igjen. Dette fungerer som en drahjelp til CAR T-cellene for videre proliferasjon når de kommer inn i kroppen.
Kymriah var det første CAR T-celle produktet som ble godkjent av FDA i 2017 til barn og unge under 25 år med tilbakefall av akutt lymfatisk leukemi av B-celletype. Godkjenningen var basert på den internasjonale ELIANA studien hvor også barneavdelingen på Rikshospitalet deltok. Denne indikasjonen er godkjent i Norge av Nye Metoder. Både Kymriah, Yescarta og to andre CAR T-celleprodukter til behandling av lymfomer og leukemier binder seg til «cluster of differentiation» (CD)19. Dette er et overflatemolekyl som vi finner på alle B-celler, fra pre-B stadiet i benmargen og frem til en moden, antigen-eksponert B-celle. Ved videre differensiering til plasmacelle taper B-cellen uttrykket av CD19. De fleste akutte B-celle lymfoblastiske leukemier og modne B-celle lymfomer uttrykker CD19 og kan dermed gjenkjennes og drepes av CAR T-celler med en anti-CD19 spesifikk CAR. I tillegg til fire CAR T-celle produkter som er rettet mot CD19, har FDA i USA godkjent to CAR T-celle produkter for myelomatose. Begge disse er rettet mot B-cell maturation antigen (BCMA), et overflatemolekyl som kjennetegner plasmaceller (tabell).
Den 28. august 2023 besluttet Nye Metoder at Yescarta også kunne tas i bruk til pasienter med DLBCL med tilbakefall innen 12 måneder etter fullføring av, eller som er refraktære overfor, førstelinje kjemo-immunterapi. Bakgrunnen var denne gang den randomiserte ZUMA-7 studien som viste klart forbedret sykdomskontroll og bedre totaloverlevelse ved Yescarta sammenliknet med standard immunokjemoterapi etterfulgt av høydosebehandling med autolog stamcellestøtte (HMAS) for pasienter med respons. Denne gangen kom godkjenningen innen ett år etter første publikasjon og det ble ikke lagt føringer på at behandlingen skulle sentraliseres til OUS. Det vil likevel ta tid før denne behandlingen blir etablert i de andre regionene.
Status
Per 31. desember 2023 har vi diskutert mer enn 35 potensielle kandidater for CAR T-celle terapi på det ukentlige, nasjonale MDT-møtet. Totalt 31 pasienter har fått høstet T-celler og 26 av disse har så langt mottatt Yescarta. Hos 22 av disse var indikasjonen residivert eller refraktær sykdom etter to eller flere linjer, mens hos 4 pasienter var indikasjonen tidlig residivert eller primært refraktær sykdom etter førstelinjebehandling. I gjennomsnitt har to pasienter fått behandling per måned dette første året, men vi fikk en markant økning etter 28. august. I forbindelse med økende pågang av pasienter, har tilgangen til leukaferese vært en begrensende faktor. Noen pasienter har måttet vente på leukaferese. DLBCL kan være en svært aggressiv kreftsykdom, og det har vært nødvendig å gi noen av pasientene kjemoterapi for å beholde sykdomskontroll i ventetiden. Dette er ugunstig både med tanke på kvaliteten på T-cellene som høstes og risikoen for å utarme benmargsfunksjonen før CAR T-celle terapi.
Seleksjon av rett pasientgruppe til denne potentielt toksiske og resurskrevende behandlingen er en utfordring. Det har vært svært få pasienter hvor vi i siste liten har måttet avlyse planlagt leukaferese eller reinfusjon av CAR T-celler på grunn av rask progresjon og tap av sykdomskontroll. Det er et mål i seg selv å holde dette antallet lavest mulig. Pasientene med r/r DLBCL har ofte kort forventet levetid og få eller ingen andre kurative behandlingsmuligheter, og det kan være spesielt tungt for pasienter med lang reisevei å oppleve at en håpefull behandling må avlyses. Vi forsøker å unngå dette ved at behandlingsansvarlig team på henvisende sykehus monitorerer pasientene tett frem mot leukaferese og reinfusjon. God og fortløpende kommunikasjon mellom OUS og henvisende sykehus gjennom MDT-møtene og andre kanaler har vært viktig. Vi har forsøkt å gjøre en riktig seleksjon av pasienter til denne behandlingen ved god kartlegging av komorbiditet og aspekter ved lymfomsykdommen. Så langt har vi tenkt at pasientene bør oppfylle de samme helsemessige kravene som vi stiller før HMAS. Dette er i stor grad i tråd med inklusjonskriteriene i ZUMA-1 og ZUMA-7 studiene som vi baserer oss på, men man kan diskutere om det er litt for strengt. I løpet av 2023 er det publisert data fra klinisk rutinebehandling med bruk av Yescarta og Kymriah ved DLBCL. Disse dataene viser at CAR T-celle terapi er mindre toksisk og bedre tolerert enn HMAS, og at det for eksempel er egnet til selekterte pasienter i høyere alder enn aldersgrensen for HMAS. Aspekter ved lymfomsykdommen kan være assosiert med redusert sjanse for effekt av CAR T-celle terapien, som raskt progressiv sykdom, affeksjon av lever og/eller flere ekstranodale lokalisasjoner, høyt tumorvolum og en systemisk høyinflammatorisk tilstand (med høy ferritin, høy LD, høy CRP målt i blod). Dette er pasienter hvor CAR T-celle terapi kan være mindre effektivt, men dette er på ingen måte absolutt og det er viktig at pasientseleksjonen til en potensielt kurativ behandling ikke blir for streng.
Resultater
Med ett års erfaring kan vi nå oppsummere tidlige resultater av de første pasientene og så vidt sammenlikne med andres erfaringer. Av de 26 pasientene som har vært behandlet frem til 31.12.23 har 25 vært til første responsevaluering en måned etter infusjon. Tretten var da i komplett remisjon og syv i partiell remisjon vurdert med CT. Det tilsvarer en total responsrate (overall response rate; ORR) på 80% og en komplett responsrate (complete response rate; CRR) på 52%. Av de 16 pasientene hvor effekten er evaluerbar tre måneder etter behandling er åtte i komplett metabolsk remisjon (CMR) vurdert med PET-CT og dette tilsvarer en komplett responsrate på 50%. Det er for tidlig å gjøre en nøyaktig evaluering av behandlingsresultatene, men inntrykket så langt er at vi oppnår responsrater som er på høyde med ZUMA-1 og ZUMA-7 studiene og sammenliknbare med data fra klinisk rutinebehandling publisert fra de største sentrene i USA og Europa (se for eksempel Nastoupil L et al. J Clin Oncol. 2020 Sep 20). Langtidsoppfølging fra ZUMA-1 studien viser en median total overlevelse på 26 måneder og en overlevelseskurve som flater ut på vel 40% etter fem år. I data fra klinisk rutinebehandling hvor både Yescarta og Kymriah er benyttet i tredje eller senere linje, rapporteres det om progresjonsfri overlevelse ved 12 måneder på 45% og total overlevelse på 64%. Dette er svært gode tall sammenliknet med medianoverlevelsen på 6 måneder etter tidligere standardbehandling for denne pasientgruppen. Vi er spente på om videre oppfølging av våre pasienter også vil ligge på dette nivået.
Bivirkninger av CAR T-celle terapi
CAR T-celle terapi er forbundet med særegne og potensielt alvorlige bivirkninger. Pasienter må monitoreres nøye og komplikasjoner håndteres optimalt for å unngå behandlingsrelatert morbiditet og mortalitet.
- CRS: Den vanligste bivirkningen er cytokinfrigjøringssyndrom (cytokin release syndrom; CRS) som vi til dels kjenner i liknende form fra andre onkologiske immunterapier som for eksempel rituximab. CRS ved CAR T-celle terapi kan imidlertid bli mer alvorlig og mer langvarig enn ved standard immunterapi. CAR T-celler er levende behandling som aktiveres og prolifererer når de kommer inn i pasienten. Ved kontakt mellom CAR T-cellene og målcellene i pasienten (dette er både normale CD19 positive B-celler og lymfomcellene) frisettes store mengder cytokiner. Mekanismene bak CRS er ikke fullstendig kartlagt, men innbefatter først frisetting av interferon-gamma (IFN-gamma) og tumor-nekrosefaktor-alfa (TNF-alfa) fra aktiverte CAR T-celler og lyserte tumorceller, etter hvert også interleukin-6 (IL6) fra aktiverte makrofager, endotel- og T-celler. Som uttrykk for CRS får nesten alle pasientene feber i løpet av de første dagene etter CAR T-infusjonen. Som ved uønskede hendelser ved kreftbehandling ellers graderes alvorligheten av CRS som grad 1-4 basert på temperatur, blodtrykk, respirasjon og oksygenmetning. Ved grad 1 har pasienten kun feber. Ved grad 2 måles lett hypotensjon og/eller hypoksi, men pasienten har effekt av paracetamol, væsketilførsel og noen få liter oksygen på nesekateter. Vi starter da behandling med tocilizumab (Roactemra®), et antistoff mot reseptoren for IL6. For de fleste pasienter med CRS grad 2 er en til fire infusjoner med tocilizumab med 8 timers mellomrom nok til å stabilisere og reversere CRS. Ved grad 3-4 er det mer alvorlig hypotensjon og/eller hypoksi, og vi må flytte pasienten til mer spesialisert avdeling som postoperativ overvåkningspost eller intensivavdeling for pressor-behandling og mer avansert respirasjonsstøtte. I samme fase som CRS opptrer er pasientene oftest neutropene etter lymfodeplesjonskuren eller tidligere kreftbehandling. Det kan være vanskelig å skille symptomene på CRS og på sepsis. Vi har derfor også et fokus på infeksjonsutredning og starter antibiotikabehandling. Av de 26 pasientene som er behandlet med Yescarta hos oss, utviklet 25 pasienter CRS. Fem fikk CRS grad 3 og måtte behandles fra ett til flere døgn ved postoperativ avdeling på Radiumhospitalet eller intensivavdelingen på Rikshospitalet. De øvrige 20 fikk CRS grad 1-2 som ble håndtert på sengeposten.
- ICANS: En annen særegen klassebivirkning ved CAR T-celle terapi er av nevrologisk karakter og kalles «immune effector cell associated neurotoxicity syndrome» (ICANS). Begrepet dekker en rekke forskjellige nevrologiske symptomer man kan observere de første dagene til ukene etter infusjonen av CAR T-celler og er uttrykk for en immunmediert encephalopati. Pasientene monitoreres for utvikling av ICANS flere ganger i døgnet. De første symptomene kan være subtile og viser seg som nedsatt konsentrasjon og orienteringsevne, mild ekspressiv afasi, apraksi eller tremor. Vi gjør en enkel og objektiv skåring av kognitiv funksjon og pasienten skriver en fast setning på et skjema. Å følge håndskriften ser ut til å være en sensitiv måte å oppdage ICANS på. Dysgrafi er et tidlig symptom og håndskriften kan gå fra å være normal til krøllete og helt uleselig på bare et par timer. ICANS graderes også etter en objektiv skala fra 1-4. Vi er raskt ute med å gi pasienten høydose deksametason ved utvikling av ICANS grad 2 eller høyere. ICANS kan ha en bi-fasisk utvikling og de første symptomene opptrer ofte kort tid etter at pasienten har fått symptomer på CRS. Disse kan som regel reverseres med tocilizumab. Senere i forløpet, etter 7-10 dager (og hos noen enda senere) kan symptomene forverres igjen. Ved ICANS grad 3 eller høyere kan pasienten være desorientert og somnolent, ha total afasi, uttalt dyspraksi, ataksi og tremor og det er risiko for utvikling av krampeanfall og i verste fall status epilepticus og hjerneødem. Pasientene med grad 3 eller høyere må flyttes til nevrologisk overvåkningspost, for OUS er dette på Rikshospitalet. Alle pasientene som skal ha CAR T-celle terapi på Radiumhospitalet settes profylaktisk på levetiracetam (Keppra) før infusjonen av cellene og fortsetter med dette til og med dag 28 etter infusjon, eventuelt lengre hvis de har hatt alvorlig ICANS. Så langt har åtte av våre pasienter hatt ICANS grad 1-2 og fem har hatt ICANS grad 3. Denne komplekse bivirkningen kan være skremmende å oppleve, ikke minst for pårørende som observerer dette, og pasienten og pårørende informeres grundig på forhånd. Heldigvis er dette syndromet reversibelt når det håndteres riktig, og sekveler eller død som følge av ICANS ses svært sjelden.
- Hypogammaglobulinemi og cytopeni: Etter B-celle rettet CAR T-celle terapi får de fleste pasientene B-celle aplasi. Denne kan bli langvarig og ledsages ofte av hypogammaglobulinemi med økt infeksjonstendens. Det er lav terskel for å gi substitusjonsbehandling med intravenøst eller subcutant immunoglobulin til disse pasientene. Pasientene kan også få langvarig neutropeni og trombocytopeni.
Håndteringen av CRS, ICANS og infeksjonskomplikasjoner ved CAR T-celle terapi krever et godt, multi-disiplinært samarbeid og kontinuerlig kommunikasjon mellom spesialistgruppene som håndterer pasientene. Gjennom dette første året med CAR T-celle terapi er det opparbeidet et tett og godt samarbeid med avdelingene for anestesi, nevrologi og infeksjonsmedisin, i tillegg til avdeling for blodsykdommer som bidrar med oppfølgning av pasientene som må flyttes til Rikshospitalet i forløpet.
Under CAR T-celle terapien er pasientene innlagt på Radiumhospitalet fra og med oppstart av kuren for lymfomdeplesjon, til og med 14 dager etter CAR T-infusjon. Deretter skal de oppholde seg innen 2 timers reisevei fra Radiumhospitalet til dag 28. Risikoen for sen utvikling av ICANS er en av årsakene til at pasienten må oppholde seg i nærheten av Radiumhospitalet såpass lenge, i tillegg til risikoen for langvarige cytopenier, hypogammaglobulinemi og ledsagende infeksjonskomplikasjoner.
For noen av pasientene våre har det blitt tydelig ganske tidlig i behandlingsforløpet at CAR T-celle terapien ikke har effekt. Det aggressive forløpet ved ukontrollert DLBCL gjør at en situasjon preget av håp og bedring under CAR T-celle terapi snur ganske fort. Det kan da være få eller ingen behandlingsmuligheter å spille på. Omsorgen for pasienter som ikke har effekt av CAR T-celle terapi er krevende. Særlig for de pasientene som kommer langveis fra, fordrer dette et godt samarbeid med pasientens lokalsykehus.
Veien videre
Det forgår en svært høy og kompetitiv forskningsaktivitet på CAR T-celle terapi og annen T-celle engasjerende immunterapi internasjonalt. Vi er inne i et paradigmeskifte innen lymfom og leukemibehandling hvor helt nye behandlingsprinsipper kommer til å prege utviklingen de neste ti årene. Denne typen behandling er også på vei inn i behandlingen av andre krefttyper og Radiumhospitalet kommer til å delta i kliniske studier med T-celle engasjerende behandling inkludert CAR T-celle terapi innen flere diagnosegrupper i nærmeste fremtid. Det er fortsatt forbedringspotensial ved CAR T-celle terapien både med tanke på effekt og bivirkningsprofil. Rett før jul 2023 publiserte FDA en rapport om at noen ganske få pasienter har utviklet aggressiv T-celle leukemi/lymfom som er CAR positiv flere år etter at de mottok CAR T-celle terapi. FDA har pålagt firmaene som prøver ut CAR T-celle terapi i kliniske studier å følge pasientene i minst 15 år nettopp med tanke på langtidseffekten av å tilføre genmanipulerte celler. Forbedring av sikkerheten ved bruken av genmanipulerte celler i pasientbehandling er en stor og viktig utfordring innen videreutviklingen av moderne celleterapi. På kortere sikt her i Norge, ser vi i 2024 frem mot etablering av CAR T-celle terapi ved flere av universitetssykehusene i Norge og en utvidelse av behandlingstilbudet til flere hematologiske maligniteter.