Forskning
![Figur 1: Illustrasjonen viser implantasjon av HAI-pumpe peroperativt hvor pumpen er plassert subkutant med kateter til arteria gastroduodenalis. Med tillatelse fra [5,6]](https://onkonytt.no/wp-content/uploads/2024/03/8.-Fig-2-1170x658.png)
Hepatisk intraarteriell kjemoterapi ved kolorektale levermetastaser og intrahepatisk kolangiokarsinom -Excalibur og TOMCAT
Tor Magnus Smedman, Overlege, Seksjon for gastrointestinal onkologi, Avdeling for kreftbehandling, Oslo Universitetssykehus
Anne M. Longva, Legespesialist, Seksjon for HPB kirurgi, Avdeling for gastro-og barnekirurgi, Oslo Universitetssykehus
Kristoffer Lassen, Overlege/seksjonsleder, Seksjon for HPB kirurgi, Avdeling for gastro-og barnekirurgi, Oslo Universitetssykehus
Bakgrunn
Hepatisk intraarteriell kjemoterapi (Hepatic Arterial Infusion/HAI) har gjennom flere tiår vært et etablert behandlingstilbud ved sentre i USA for pasienter med kolorektale levermetastaser (CRLM). Flere studier har vist gunstig effekt, men publikasjonene stammer fra noen få miljøer og det mangler randomiserte data. Behandlingen har så langt ikke fått fotfeste i Europa. Imidlertid har det de siste årene vært økende interesse for intraarteriell kjemoterapi, både i USA og Europa. I 2021 ble det startet en randomisert kontrollert studie ved Rikshospitalet, Excalibur (EXtended CriteriA treatment for LIver metastases with heavy tumour BURden), som blant annet skal undersøke effekten av HAI hos pasienter med CRLM med høy tumorbyrde. I løpet av 2024 er det planlagt oppstart av en studie for pasienter med ikke-resektabelt intrahepatisk kolangiokarsinom (TOMCAT).
Kolorektale levermetastaser
Leveren er det organet med hyppigst forekommende fjernspredning fra kolorektal kreft [1]. Rundt halvparten av pasienter med kolorektal kreft har levermetastaser på diagnosetidspunktet, eller vil i løpet av sykdomsforløpet utvikle dette. Leverreseksjon er ansett som den eneste etablerte behandlingsmodaliteten med kurativt potensial. Ved diagnosetidspunkt er imidlertid 75-80% av pasientene ikke-resektable, enten på grunn av for omfattende tumorutbredelse i leveren eller på grunn av ekstrahepatisk sykdom.
Ved utbredt metastasering i leveren behandler man ofte med systemisk kjemoterapi med mål om å oppnå resektabilitet, noe som oppnås hos et begrenset antall (22-57 %) [2]. Det er imidlertid usikkerhet knyttet til disse tallene, da det er stor variasjon i hva som initialt vurderes som ikke-resektabel sykdom. 5-års totaloverlevelse (OS) etter leverreseksjon varierer fra 25-50 % og er avhengig av en rekke faktorer, som inkluderer CEA, KRAS/BRAF status, antall/størrelse på lesjoner og synkron/metakron sykdom. Hos pasienter hvor man ikke oppnår resektabilitet vil behandlingen bestå av palliativ kjemoterapi, med en forventet 5-års OS på 10-15 % [3,4].
Hepatisk intraarteriell kjemoterapi
Hepatisk intraarteriell kjemoterapi er en behandling hvor kjemoterapi gis direkte inn i leverarterien via en subkutan pumpe. Det anatomiske rasjonale bak intraarteriell kjemoterapi i lever er at leversvulster nesten utelukkende får sin blodforsyning via leverarterien, og i svært liten grad via portvenen (vena portae). Floxuridin (FUDR) er det best studerte og foretrukne kjemoterapeutiske middelet som brukes i HAI-behandling grunnet stoffets gunstige farmakokinetiske egenskaper. FUDR har ca. 95 % førstepassasjemetabolisme i leveren og rask utskillelse, noe som muliggjør opptil 400 ganger høyere dose til leveren sammenlignet med konvensjonell systemisk kjemoterapi. På grunn av høy grad av metabolisering i leveren når svært lite FUDR systemisk sirkulasjon, og gir derfor minimalt med systemiske bivirkninger.
Ved Rikshospitalet implanteres HAI-pumpe med en åpen operasjon (laparotomi). HAI-pumpen plasseres subkutant i nedre kvadrant av buken, fortrinnsvis på pasientens venstre side. Et kateter fra pumpen trekkes gjennom fascien og inn i bukhulen hvor kateteret plasseres i arteria gastroduodenalis ved innmunningen til leverarterien (Fig. 1). Kirurgisk implantasjon av HAI-pumpe innebærer lav risiko for komplikasjoner, hvor de vanligste komplikasjonene er sårinfeksjon og blødning. Pasienten er inneliggende på avdelingen i 3-6 dager for postoperativ behandling. Før utskrivelse blir pumpefunksjonen testet ved kontrastinjeksjon og angiografi som bekrefter arterieanatomi, bilobær distribusjon og fravær av kontrastovergang til nærliggende organ via mindre arterier. I tillegg utføres en scintigrafi for å utelukke ekstrahepatisk perfusjon. Implantasjon av HAI-pumpe krever at pasienten må ha opphold fra kjemoterapi-behandling i minimum 3 uker preoperativt og 2 uker postoperativt.
![Figur 1: Illustrasjonen viser implantasjon av HAI-pumpe peroperativt hvor pumpen er plassert subkutant med kateter til arteria gastroduodenalis. Med tillatelse fra [5,6]](https://onkonytt.no/wp-content/uploads/2024/03/8.-Fig-2-1017x1024.png)
Figur 1: Illustrasjonen viser implantasjon av HAI-pumpe peroperativt hvor pumpen er plassert subkutant med kateter til arteria gastroduodenalis. Med tillatelse fra [5,6]
En studie fra 2006, som randomiserte 135 pasienter med ikke-resektable CRLM til systemisk kjemoterapi (FLV) versus HAI fant man signifikant økt OS i HAI-armen (24 versus 20 måneder), men tid til ekstrahepatisk progresjon var signifikant kortere i HAI-armen, noe som har ført til at man nå alltid gir systemisk kjemoterapi sammen med HAI [7]. En senere fase II-studie fra MSKCC undersøkte HAI sammen med mer moderne kjemoterapi-regimer hos 49 pasienter med ikke-resektable CRLM [8]. Majoriteten av pasientene i denne studien var tidligere behandlet og hadde median 14 metastaser i leveren. Man fant i denne studien objektiv responsrate på 76 % og oppnådde reseksjon hos 47 % av pasientene median 6 måneder fra behandlingsstart.
Den samme gruppen fra MSKCC publiserte i 2023 en artikkel med retrospektive data som så på 58 kjemoterapi-naive pasienter med ikke-resektable CRLM [9]. Fire pasienter (7 %) oppnådde langvarig komplett respons og man oppnådde reseksjon hos 55 %. Samlet hadde disse pasientene en 5-års OS på 72 %, noe som er imponerende, også sammenliknet med primært resektable CRLM.
På tross av at flere observasjonelle studier har vist gunstig effekt, er det enighet om at det er behov for randomiserte data før man kan konkluderer om nytten av HAI. Det er ikke utført randomiserte studier som undersøker HAI sammen med moderne systemisk kjemoterapi mot moderne systemisk kjemoterapi alene. Dette er bakgrunnen for oppstart av Excalibur studien i 2021. Det er i tillegg nylig startet en stor multisenter randomisert kontrollert studie i USA, som er tilsvarende Excalibur-II studien [10].
Toksisitet
Den mest alvorlige langtidskomplikasjonen til behandling med intrarteriell hepatisk floxuridine er galleveistoksisitet. Biliær toksisitet kan resultere i alt fra lett forbigående stigning i lever/galleprøver til irreversible skader i galleveier. I sin mest alvorlige form kan det medføre skleroserende kolangitt med typisk strikturdannelse i ekstrahepatiske galleveier. Ved alvorlig toksisitet seponeres behandling og det startes behandling med deksametason adminstrert i HAI-pumpen og peroral ursodeoksykolsyre (Ursofalk). I alvorlige tilfeller kan det være behov for ERCP med blokking og stenting for å sikre galledrenasjen. I internasjonale studier angis insidensen av biliær sklerose på ca. 5 % [11]. Det er derfor essensielt at pasientens lever- og galleprøver følges tett under behandlingen og at det er stor grad av kompetanse og årvåkenhet blant behandlere.
Excalibur-studien
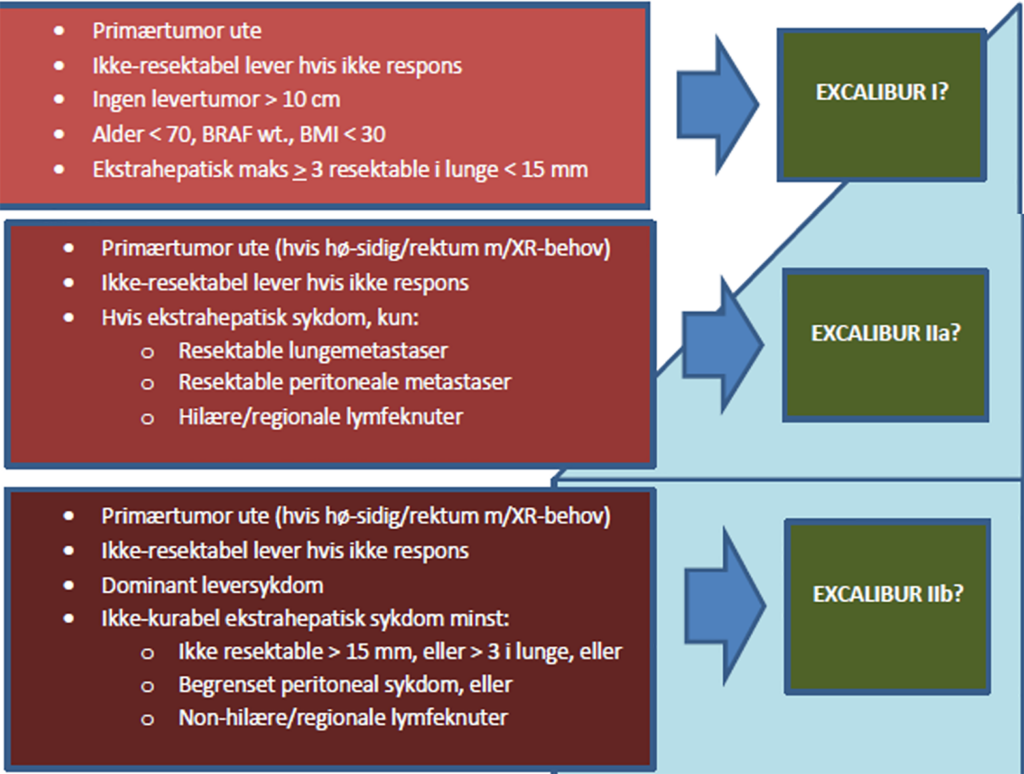
Excalibur-studien utgår fra HPB-avdelingen ved Rikshospitalet i Oslo og er en randomisert kontrollert studie inndelt i Excalibur 1 og 2 (Fig. 2). Studien inkluderer pasienter med ikke-resektable CRLM hvor det er behov for linjebytte grunnet progresjon eller toksisitet. I Excalibur 1 randomiseres pasientene mellom tre ulike armer: neste linje kjemoterapi og levertransplantasjon eller neste linjes kjemoterapi og HAI-pumpe eller neste linje kjemoterapi alene (standard behandling). Inklusjon i Excalibur 1 krever at primærtumor er fjernet og pasienten har begrenset ekstrahepatisk sykdom; det aksepteres maksimalt tre resektable lungemetastaser under 15 mm. I Excalibur 2 aksepteres pasienter med noe mer ekstrahepatisk sykdom. Pasienter med venstresidig koloncancer eller rectumcancer uten behov for preoperativ strålebehandling, kan inkluderes med primærtumor in situ. Excalibur-2-studien er nylig blitt utvidet med en protokoll hvor det ikke er krav om indikasjon for linjebytte (Excalibur IIc). I denne protokollen inkluderes pasienter med CRLM med stor tumorbyrde med respons på inneværende kjemoterapi-linje, men hvor det vurderes lite sannsynlig at man oppnår resektabilitet.
Excalibur-studien har løpende inklusjon. Pasienter som ønskes vurdert for studien kan henvises til MDT (“levermøtet”) ved HBP avdelingen ved Rikshospitalet. Det er ønskelig at henvisende lege tar kontakt med studiepersonell direkte for raskere vurdering. Studien er pågående og forventes ferdig inkludert i løpet av 2024. Totalt skal studien inkludere 45 pasienter.
Mer informasjon om studien finnes på på https://excaliburstudy.com/
TOMCAT
I løpet av første halvdel av 2024 planlegges oppstart av den kliniske studien TOMCAT (trans-arterial treatment modalities for intra-hepatic cholangiocarcinoma not amenable to resection) ved Rikshospitalet. Studien inkluderer pasienter med intrahepatisk kolangiokarsinom som er vurdert som ikke-resektable. TOMCAT er en ikke-randomisert, to-kohortstudie hvor pasienter blir fordelt mellom to ulike intervensjonsarmer i tillegg til systemisk (konvensjonell) kjemoterapi (GemOx): enten HAI eller SIRT (selektiv internal radiation therapy). Pasienter blir hovedsakelig selektert basert på tumor-karakteristika. Primært endepunkt er median overlevelsestid.
Referanser
1 Engstrand J, Nilsson H, Strömberg C, et al. Colorectal cancer liver metastases – a population-based study on incidence, management and survival. BMC Cancer. 2018;18:78.
2 Bolhuis K, Kos M, Oijen MGH van, et al. Conversion strategies with chemotherapy plus targeted agents for colorectal cancer liver-only metastases: A systematic review. Eur J Cancer. 2020;141:225–38.
3 Cremolini C, Loupakis F, Antoniotti C, et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol. 2015;16:1306–15.
4 Bond MJG, Bolhuis K, Loosveld3 OJL, et al. LBA21 – FOLFOX/FOLFIRI plus either bevacizumab or panitumumab in patients with initially unresectable colorectal liver metastases (CRLM) and left-sided and RAS/BRAFV600E wild-type tumour: Phase III CAIRO5 study of the Dutch Colorectal Cancer Group.
5 Sharib JM, Creasy JM, Wildman-Tobriner B, et al. Hepatic Artery Infusion Pumps. Ann Surg. 2022;276:943–56.
6 Lidsky ME, Cercek MA, Maithel MSK, et al. Hepatic Arterial Infusion Pump Chemotherapy: Is It Ready for Prime Time in the United States? 2023. https://dailynews.ascopubs.org/do/hepatic-arterial-infusion-pump-chemotherapy-ready-prime-time-united-states (accessed 1 December 2023)
7 Kemeny NE, Niedzwiecki D, Hollis DR, et al. Hepatic Arterial Infusion Versus Systemic Therapy for Hepatic Metastases From Colorectal Cancer: A Randomized Trial of Efficacy, Quality of Life, and Molecular Markers (CALGB 9481). J Clin Oncol. 2006;24:1395–403.
8 D’Angelica MI, Correa-Gallego C, Paty PB, et al. Phase II Trial of Hepatic Artery Infusional and Systemic Chemotherapy for Patients With Unresectable Hepatic Metastases From Colorectal Cancer. Ann Surg. 2015;261:353–60.
9 Verheij FS, Kuhlmann KFD, Silliman DR, et al. Combined Hepatic Arterial Infusion Pump and Systemic Chemotherapy in the Modern Era for Chemotherapy-Naive Patients with Unresectable Colorectal Liver Metastases. Ann Surg Oncol. 2023;1–10.
10 ECOG-ACRIN Cancer Research Group. https://ecog-acrin.org/clinical-trials/ea2222-pump-colorectal-cancer/ (accessed 29 November 2023)
11 Ito K, Ito H, Kemeny NE, et al. Biliary Sclerosis after Hepatic Arterial Infusion Pump Chemotherapy for Patients with Colorectal Cancer Liver Metastasis: Incidence, Clinical Features, and Risk Factors. Ann Surg Oncol. 2012;19:1609–17.