Utdanning og møter

ESTRO 2023: From innovation to action Palliativ omsorg i en ny tid – refleksjoner og møtereferat
Det var mange år siden jeg hadde vært på ESTRO og gledet meg som et barn. Kongressen svarte til forventningene med utrolig mange flotte foredrag, hyggelige møter med kollegaer fra inn- og utland, også avtaler og besøk i utstillingshallen ga utbytte. Tross regnvær var Wien en fantastisk by og et vell av kulturelle opplevelser.
Liv Ellen Giske, Overlege, Kreftavdelingen, Sykehuset Innlandet, Gjøvik
Det lønner seg å vite hva en vil prioritere, da får en mest utav oppholdet. Jeg valgte å fokusere på palliasjon, samtidig som jeg fikk med meg mye annet spennende også, spesielt aktuelle diskusjoner rundt brystkreftbehandling.
«Palliative care: Patient’s and physician’s journey in the era of new treatments and radiation techniques». Overskriften fenget; pasientens og legens reise… Ja, for det har vært en reise for oss som startet med simulator og direkteinnstilling på apparat, ett felt bakfra, kilde-hud-avstand og manuell konturtagging med «strikkepinner». Vi lærte mye av erfarne stråleterapeuter, ikke minst at vi måtte jobbe så fort og stille som mulig for at pasienten skulle bruke kortest mulig tid på simulator.
For pasientene har det også vært en reise med en enorm tilvekst av behandlingsmuligheter. Dette har ikke bare gitt økte kurasjonstall, men betydelige muligheter for ny behandling når sykdommen residiverer og metastaserer.
I tillegg til mange nye systemiske behandlingsmuligheter, har vi hatt en enorm teknisk utvikling innen stråleterapi. Jeg forventa å bli skikkelig oppdatert på fraksjoneringsmønstre og foretrukne teknikker, godt begrunna i forskningsrapporter og erfaringer fra kloke kollegaer ute i den store verden. Som leger må vi være tilpasningsdyktige og oppdaterte på nyvinninger som kommer pasientene til gode, men vår kritiske sans er også viktig. Ikke alt nytt betyr en forbedring, og hva er forbedringen, har den egentlig klinisk konsekvens? Vi har hatt noen paradigmeskifter i faget vårt, men de fleste endringer baserer seg på langt mindre prosentuell forbedring.
Mine spørsmål før kongressen var bl.a.: Engangsfraksjoner når? Andre aktuelle fraksjonsmønstre? Stereotaksi og IMRT i palliasjon?? Når det enkle er godt nok, hvorfor da gjøre ting komplisert? Og komplisert for hvem? For meg? For doseplanleggerne? For de på behandlingsapparat? Og hva med pasienten? Tre av foredragene omhandlet ikke stråleterapi i det hele tatt.
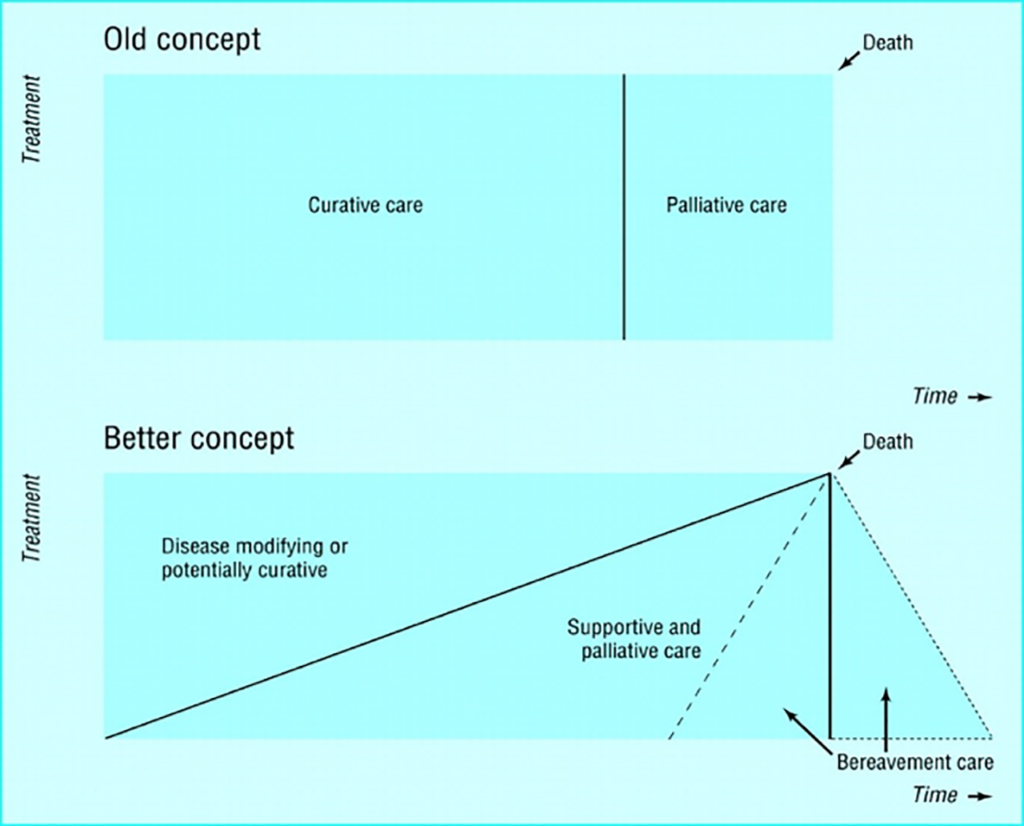
Med sitt åpningsforedrag: «Advance care planning: How early should palliative care start?», satt Yvette van der Linden fra Nederland både stemning og standard for dette 7 timers lange formøte-programmet. Pasienten og pasientens beste var i sentrum. Hun snakket om at vi tidlig nok måtte integrere samtalen om palliasjon. Van der Linden mente at vi har en tendens til å utsette å snakke om palliasjon, og at palliasjon starter mye tidligere og mer gradert i sykdomsforløpene nå enn slik vi tenkte før. Hun refererte bl.a. til Murray et al sin artikkel i BMJ 2005 (Figur 1).
Advance care planning er pro-aktiv planlegging for å definere mål og preferanser frem i tid sammen med pasient og pårørende, og med rom for endring underveis. Hun (van der Linden, red.anm.) snakket om at vi leger forholder oss til det fysiske (den nederste delen av Maslow’s pyramide fra 1943); sykdommen, symptomer og behandling – og det må vi selvsagt. Men at god palliativ omsorg ivaretar hele mennesket med også psykologiske, sosiale og åndelige dimensjoner. Selv en pasient som kommer for strålebehandling av en skjelettmetastase har ofte mer eksistensielle bekymringer. Når vi greier å integrere dette i vår tilnærming til pasient og pårørende, vil de føle seg sett og ikke som et nummer i rekka.
«Blir jeg overrasket om denne pasienten lever om 1 år?»
Og motsatt: «Blir jeg overrasket om denne pasienten er død om 1 år?»
Van der Linden oppfordret oss til «two track approach», hvor det kurative og palliative løpet snakkes om samtidig og tidlig nok. Utsetter en å snakke om døden, kommer den ofte brått og brutalt, sammenfallende med mange plagsomme symptomer og mindre rom for gode samtaler og planlegging.
Resultater fra relativt like spørreundersøkelser i flere land har vist nytten av at vi spør oss selv: «Blir jeg overrasket om denne pasienten lever om 1 år?» Og motsatt: «Blir jeg overrasket om denne pasienten er død om 1 år?» Dette gir økt bevissthet rundt behovet for palliativ omsorg.
Og mange studier viser at tidlig integrert palliativ omsorg gjør at den siste tiden blir mer slik en ønsker, både for pasient og pårørende, bl.a. med færre sykehusinnleggelser.
Hun viste eksempler på enkle spørsmål som raskt ivaretar både det fysiske, psykiske, sosiale og eksistensielle. Hun mente også at vi som leger hadde godt av å gå gjennom disse spørsmålene for oss selv.
Palliativ omsorg er teamarbeid, det kreves kunnskap, kreativitet, kommunikasjonsevner og empati. Kun en mindre andel av pasientene krever svært spesialisert palliasjon. Vi må spille på hverandres styrker og også kjenne på egne grenser. I Holland jobbes det med kompetanseløft for palliasjon.
Joanna Kazmierska fra Polen fulgte senere på dagen opp med et foredrag om kommunikasjon med undertittelen: «Hva er sagt? Hva er hørt?», for det er det det handler om, mente hun. Og det gjelder også andre veien, det er ikke alltid vi har hørt hva pasienten har sagt.
Hvorfor er kommunikasjon så vanskelig? Kunnskap er ikke det samme som å forstå. Når vi snakker om bivirkninger for eksempel, ber vi egentlig pasienten om å forestille seg noe han ikke har noe forhold til. Det aller viktigste i god pasient-lege-kommunikasjon er relasjonen. Den bygger på tillitt, og gjør samtalen om de vanskelige tingene enklere, også for legen.
Kazmierska snakket om hva som er våre barrierer, hva hos oss som gjør det vanskelig både å gi dårlige beskjeder samt ta beslutninger om behandlingen mot slutten av livet. Frykt for egen dødelighet, for egne og andres følelser, skyldfølelse og skuffelse når vi ikke kan helbrede, slitenhet og stress er noen av svara. For pasient og pårørende er misforståelser, endringer i roller, sterke følelser og mangel på støtte bl.a. barrierer.
Hvordan kommunisere dårlige nyheter? Mange pasienter ønsker å være med å bestemme når og hvor og sammen med hvem, men det er viktig at det skjer tidlig nok. Det viser seg at de fleste pasienter kun husker omtrent 20% fra en slik samtale. Kazmierska mente også at legens følelser, mer enn pasientens livskvalitet, kan være avgjørende for når legen avslutter tumorrettet behandling.
«Hvor lenge har jeg igjen å leve?» Spørsmålet handler om prognose og håp. Det gir muligheter for en god siste tid og nye små håp i hverdagen, men er også svært utfordrende. Spesielt i tilfeller der pasienten har urealistiske håp og dette støttes av legen, fordi han/hun også er lei seg grunnet egne følelser i saken.
I en oversikt fra tidlig 2000-tall visste bare 14 % av legene hvor pasienten ønsket å være når han døde. For pasientene er det viktig at de føler at legen er komfortabel med å snakke om døden.
Kazmierska refererte til SPIKES-modellen, beskrevet av Baile og Lenzi i The Oncologist fra 2000, hvor rammene for å gjøre dette på en god måte er satt opp. Hun inviterte – som van der Linden – til selvrefleksjon, og hun avsluttet med noen «To do and not to do». Si aldri «jeg forstår hvordan du har det», for det gjør vi ikke. Og vær ikke redd for stillhet, den er nødvendig!
Mot slutten av dagen snakket Caroline Hertler fra Sveits om spesielle utfordringer i terminalfasen, altså de siste dager til uke(r). Hun ba oss være var på hvordan vi ordlegger oss. Behandling slutter ikke når tumorrettet behandling opphører, den finner bare ny retning. Og at pasienten får riktig behandling i denne tiden er viktig, både for den døende og de som står nær og skal leve videre.
Hun gikk spesielt inn på smerte, dyspnø og blødning, og minnet oss på at alt vi tenker på i kurativ setting, må vi også tenke på i terminalfasen. Hvordan er smerten? Kan den skyldes noe annet enn den opplagte tumorsmerten? Hun snakket om den totale smerten som ikke minst påvirkes av det en skal dø fra. Smerte i terminalfasen er en spesiell smerte. Forventes akutt blødning i terminalfasen er det viktig at både pasient og pårørende er informert, og at en har en plan for hvordan dette skal håndteres. Diffus småblødning forutsier ofte større blødning.
Den gode død, er den mulig? Da er alle forberedt og godt informert med tid nok til å snakke om de viktige tinga. Hun minnet om at spesielt hos pasienter med primære hjernetumores er det viktig å være tidlig ute. 90% av dem har allerede på diagnosetidspunktet en viss grad av kognitiv svikt. Hertler påpekte også vårt ansvar for at det skal gå best mulig med de etterlatte. Vår jobb slutter ikke med døden, mente hun. Det er påvist økt dødelighet hos pårørende, spesielt kardiovaskulær død, det første halvåret. Dette minner oss om hvilket enormt stress også de etterlatte har vært utsatt for. 10-20% får forlenga sorgreaksjon med redusert funksjonsnivå og depresjon, for noen også med suicidale tanker.
Carsten Nieder fra Bodø og Norge holdt et interessant foredrag: «Prediction of survival – hype or useful tool for health care professionals». Allerede i 2014 var han medforfatter av boka «Decision Tools for Radiation Oncology». Han refererte til flere studier, både eldre og yngre, om hvor vanskelig det er å forutsi forventet levetid. PS (performance status, red. anm.) viser seg å være den viktigste enkeltfaktoren. Han viste forskjellige verktøy for å predikere livslengde og at dette var nyttig i klinikken.
LabBM er et slikt verktøy, opprinnelig laget for å vurdere pasienter med hjernemetastaser. Nieder og kollegaene i Bodø fant at dette kunne brukes ved alle slags palliative pasienter, og de laget et tilsvarende verktøy som de kalte LabPS. Som i LabBM gjøres 5 blodanalyser; Hb, trombocytter, Albumin, LDH og CRP. Avvik gir en fastsatt score (0, 0.5 eller 1), ECOG-status skåres også (ECOG 0-1=0p, 2=0,5p og ECOG 3-4=1p). De skåret og fulgte 375 pasienter som fikk strålebehandling med ulike regimer. Det var høy korrelasjon mellom høy totalskår og rask død. Alle pasientene med ECOG 3-4 og 5 unormale blodprøver døde innen 35 dager. På den annen side levde alle med normale blodprøver og ECOG 0-1 etter 6 mndr. Det finnes også et onlineverktøy laget av JC Farris, som kan brukes for prediksjon.
Alle verktøy har til hensikt å hjelpe oss å velge ut riktig behandling for riktig pasient. Et dilemma er de som havner i en dårlig prognosegruppe, men viser seg å være langtidsoverlevere. Også Nieder kom med overraskelses-spørsmålet: “Hvor overrasket blir jeg om denne pasienten lever om 3 mndr? I 1 år?» Vi må passe oss for å bruke opp tiden til en pasient med svært kort forventet levetid.
Nicolaus Andratschke fra Sveits snakket om «Standards and Innovation in palliative RT» og da spesielt fokus på rebestråling. Det er ulike scenarier: full overlapp, partiell overlapp og situasjoner hvor kumulativ dose gir utfordringer, enten til bestrålt organ eller OAR (organ at risk, red.anm.). Og en må skille mellom repetert strålebehandling til et organ, og når overlappen skyldes rebehandling i ulike organ. Det har vært et økende antall publikasjoner om rebestråling, med gode rapporterte kliniske parametre. Men utover fraksjoneringsmønstre har svært få registrert detaljerte stråledata, så som dosimetri, volumer, OAR-data m.m. Overføringsverdien blir da usikker, selv om konklusjonene kan være riktige. Han viste til en rekke systematiske reviews og nye konsensus-guidelines, men mye er fortsatt uavklart.
Også Andratschke snakket mye om pasientseleksjon. Han trakk fram en systematisk reviewartikkel av Drodge et al fra 2014, hvor de så på symptomkontroll ved palliativ mediastinal bestråling. Hemoptyse, dyspnø, obstruksjon og smerte var indikasjonene. 69% hadde respons og noen var, palliasjon og rebestråling til tross, langtidsoverlevere.
Hva kjennetegnet disse pasientene, altså hva predikterte god og langvarig effekt (>2 år)? Det så ut som totaldosen hadde noe å si, men ved ensidig å se på dose, kan en overse toksistetsbildet og gi for tøff behandling til pasienter som ikke bør ha det. En gikk derfor andre vegen og fant at KPS>=80, planned target volum <300c, fravær av metastaser og ekstratorakal sykdom, samt tid til residiv >1 år etter primærbehandling, skilte seg ut som prognostisk gunstige faktorer. Slik kan en ved å ta hensyn til hvordan pasienten har det og tumorkarakteristika, beslutte hvem som antas å ha nytte av en høyere dose. Og hvem som, for kortvarig symptomlindring, bør ha lavere totaldoser.
Ved beslutning om rebestråling er effekt av tidligere behandling, tidligere og evt. gjenværende toksisitet samt tid til residiv viktige parametre. Dette sammen med PS, vil da hjelpe oss i beslutningen om en ved rebestrålingen skal gå for høyere dose for bedre tumorkontroll. I tillegg kommer betraktninger for OAR. Hva er ansett som trygge doser? For medulla spriker det fra 56 til 65 Gy, men også andre forhold spiller inn, som tid siden forrige behandling. Ut ifra dagens viten er det kun CNS (hjerne og medulla) som har recovery.
Til mindre volum som blir bestrålt, til større er toleransen (volumeffekten). Hva er trygt for lungene? Pneumonitt-risiko øker ikke ved rebehandling på samme sted, men (avhengig av lokalisasjon) kan risiko for costafraktur øke. Ved repetert lungebestråling (annet sted) øker sjansen for pneumonitt.
Andratschke viste eksempler på multiple lesjoner og repetert SBRT (stereotactic body radiotherapy, red.anm.). Overlevelsesdata brukes som surrogat for toksisitet. I SBRT-studier med svært høye doser til sentrale luftveier, kom mer fraksjonert behandling bedre ut med hensyn til toksisitet. Også dette var studier uten volumdata og tilstrekkelig informasjon om kumulative doser. Materiale fra eget hus viste vel tolererte svært høye kumulative doser i thoraks. I en rebestrålingssituasjon anbefalte han likevel mer forsiktig fraksjonering.
De fleste som gir rebestråling, gjør dette på individuell basis uten vedtatte retningslinjer. Det er derfor viktig å komme sammen og prøve å bli enige om noe. For ØNH-kreft og glioblastom finnes verktøy for rebestråling, som i det minste kan gi oss hint om veien videre. Lokoregional kontroll er god grunn til rebestråling, selv om overlevelsen ikke øker. Ved rebestråling av ØNH-kreft snakkes det om risikoen for carotis blow-out (letal veggruptur i a. carotis). Den ligger i størrelsesorden 2-12,5%, med økt risiko ved ung alder, carotisinvasjon på mer enn halve sirkumferensen, og bruk av SBRT. Likeledes doser over 120 Gy med konvensjonell fraksjonering og >100 Gy ved SBRT (EQD2) samt parametre som hudinvasjon, abscess og ulcera.
Det foregår et arbeid i regi av ESTRO under ledelse av fysikergruppa for å prøve å standardisere rebestråling. Viktige spørsmål er α/β, antagelser for recovery, dosekalkuleringsmodeller m.m. E2-Radiate, en EORTC- observasjonsstudie hvor en ønsker at klinikere sender inn data. Det er 3 kohorter – Oligo-care, ParticleCare og ReCare. Her oppfordres vi alle til å delta.
Joanne van der Velden fra Utrecht gikk gjennom utviklingen av «Fast track clinic», fra begynnelsen i Toronto til nå, og fordelen dette har hatt spesielt for palliative pasienter. I Utrecht startet de i 2014, da med én pasient per dag, nå behandler de 4 lokalisasjoner per dag. Målet for de aktuelle pasientene er at de får behandling innen 48 timer etter at den er rekvirert og at totaltiden på sykehuset kun skal være 3 timer. Forutsetningene er dedikerte team, samt avsatte slots til både lege, CT og behandlingsapparat.
I Utrecht ble antall ø-hjelpspasienter i helger halvert. Med dette kan en også gir flere sårbare pasienter muligheten til behandling ved at det blir færre oppmøter, ideelt sett bare ett. Flere pasienter ble på denne måten behandlet med engangsfraksjon ved smertefulle metastaser, som anbefalt. Men det kan også være aktuelt for pasienter med lungecancer og blødninger, eller der hjernestereotaksi er aktuelt. Der engangsfraksjoner mot slutten av livet kan gi meningsfull symptomlindring, er dette et viktig tiltak. Utfordringer skjer dersom situasjonen er mer komplisert enn forutsett, samt oversett interaksjonsproblematikk med systemisk behandling grunnet tidspress og forventninger fra pasienten.
Fra 2019 har de prøvd «same-day MR-linac guided RT» for smertefulle skjelettmetastaser, og fra 2020 introduserte de VMAT-planlegging for disse pasientene. Kan det gjøres enda raskere? I FAST-METS-studien i Amsterdam tegnet en inn MV på diagnostiske CT-bilder og brukte CBCT som kontroll, og også for replanlegging om nødvendig og mulig. Medgått tid gikk ned til 85 min, derav 30 min for pasienten i behandlingsrommet. Dagens innovasjon inkluderer strålebehandling uten forutgående doseplan-CT, og SBRT med MR-linac på samme dag, avsluttet van der Velden.
Hun poengterte også viktigheten av å forklare pasientene hva som skjer «når det ikke skjer noe»
Stråleterapeut Madalyne Chamberlain fra Zürich gikk gjennom vårt felles ansvar for at pasienten skal ha nytte av og å orke og gjennomføre behandlingen, og hvordan de strukturert screenet pasientene før stereotaktisk behandling. Stikkord er PS, compliance, evne til å ligge stille lenge nok, god kommunikasjon og gjentatt informasjon. Hun poengterte også viktigheten av å forklare pasientene hva som skjer «når det ikke skjer noe». God informasjon reduserer angst og bekymringer før og under behandlingen. Pasientkomfort er nøkkelen, og hun presiserte nytten av å bruke gode monitoreringssystemer, også aktivt på palliative pasienter. Hun snakket om tid, robusthet og besparelse av OAR, hvor det kan være andre prioriteringer enn hos kurative pasienter.
Dette ble etterfulgt av et nytt foredrag av N.Andratschke, stråleonkolog i Zürich. «What to consider for stereotactic radiotherapy in palliative patients –Practical considerations». Stereotaksi er ideelt ved mindre volumer, men grensen for akseptert tumorstørrelse har økt. Dosedistribusjonen er annerledes enn ved konvensjonell behandling, og en utnytter inhomogeniteten for å komme opp i høye doser i tumor. Det har ikke vært en ensartet måte å foreskrive dosen på, så sammenligninger kan være vanskelig. Samme dose til PTV kan bety forskjellig dose til tumor. En har sett opp til 95% lokal kontroll. Med potensielt svært høy tumordose med bratt dosefall, sparing av risikoorganer, lav akutt toksisitet og kort behandlingstid, er dette godt egnet for palliative pasienter. Som oftest har en kun GTV og liten margin til PTV.
Stereotaksi egner seg godt som eneste behandling til eldre skjøre pasienter med NSCLC, det er bedre overlevelsesdata enn ved konvensjonell behandling. Forskjellige regimer kan velges ut ifra toksistetshensyn, 15 Gy x 3, 12 Gy x 4 og 7,5 Gy x 8. Stereotaksi har vist god lokal kontroll ved hepatocellulært carcinom hos skjøre pasienter som ikke tåler sedvanlig kurativ tilnærming,
Stereotaksi ved oligometastaser har vist økt PFS og OS for flere tumorgrupper. For første og eneste metastase, og også ny oligo, er prognosen bedre enn når det foreligger flere metastaser. Resultatene bør bekreftes i større kohorter. Andratschke anbefalte også SBRT hos noen pasienter med disseminert sykdom. En kanadisk studie viste bedre symptomlindring ved 12 Gy x 2, enn 4 Gy x 5. Ved mer systemisk behandling lever mange av pasientene lenger, og en kan t.o.m. komme i situasjoner der primærtumor bør blir behandlet, stadium IV-sykdom til tross. Han er opptatt av at vi velger ut de riktige pasientene og at vi bruker moderne teknikker der pasienten har nytte av det, med færre oppmøter vil vi også kunne nå pasienter som ellers ikke får behandling. Han fortalte til slutt om deres egen BoneShot-studie, hvor pasienten med 65 min total liggetid på bordet, fikk MR-guidet engangsfraksjon mot smertefulle skjelettmetastaser.
To av foredragene omhandlet spesielle behandlingsmetoder. Først ut var Peter Hoskin fra UK, som snakket om brachyterapi i palliasjon. Det er få publikasjoner og de fleste med få pasienter. Best nytte er det ved vist øsofaguscancer, men også ved rektum- og gyncancer, samt ved affeksjon i hud og underliggende vev, hvor anatomien er utfordrende. Brachyterapi er konform, har optimal dosedistribusjon og bratt dosegradient. Den kan redusere bulky tumor samt symptomer som dysfagi og blødning, og den kan brukes der rebestråling ellers ville være krevende.
Orit Kaidar-Person fra Israel snakket om «Lattice RT for store lesjoner». Ingen i salen hadde egenerfaring med denne type behandling. Hun refererte til en artikkel fra 1933. Dette er altså en gammel behandlingsmåte, hvor en før linacenes tid kunne behandle i dypet og samtidig hudbesparende ved å gi mange tynne felt med høy dose. Denne gitterbehandlingen har sin egen biologi, og mye er ukjent. Hun viste til egen erfaring og enkelte nyere publikasjoner, men det er få pasienter og vanskelig å komme med entydige råd. Hun mente, tross krevende planlegging, at dette kunne ha sin plass i spesielle situasjoner hvor palliative doser ikke vil ha effekt, og hvor høyere doser utfordres av OAR. Som ellers er det viktig å velge ut de riktige pasientene som kan ha nytte av dette.
Bianca Hoeben fra Utrecht holdt innlegg om utfordringene og mulighetene ved palliativ strålebehandling hos barn/unge voksne. Den største utfordringen er å vite når en virkelig kun snakker om symptomlindring. På den andre siden er nytten av behandlingen mindre om den gis i livets siste 30 dager. Hun snakket av egen erfaring og med referanse til litteraturen. Svært få barn/unge voksne tilbys strålebehandling, og hovedbarrieren er bekymringer for toksisitet. Indikasjoner, lokalisasjoner og teknikk er likt som for voksne, men histologien er annerledes. Generelt er disse svulstene svært radiosensitive, og ofte med effekt allerede etter 1 uke. Noen gikk i langvarig komplett respons. De fleste fikk fraksjonsdoser på 2,5 Gy eller mer, og Hoeben’s erfaring var at akutt-toksisiteten var mindre hos barn enn hos voksne. Kun hos 10% er anestesi nødvendig. Hun la også frem resultatet av en studie med stereotaktisk strålebehandling til isoeffektive doser for barn med sarkom/neuroblastom. Her fant de (med unntak for lesjoner i orbita og vertebra) største besparelse til OAR ved å gi 3 eller 5 fraksjoner mot 20-30 fraksjoner med konvensjonell behandling. Ved diffust intrinsic pontin gliom, hvor det ikke finnes kurasjon, er hypofraksjonering å anbefale. Nye guidelines ble publisert i 2021.
Hoeben snakket også om spesielle utfordringer hos unge voksne, og våre utfordringer som helsepersonell i møte med disse pasientene, der (urealistiske) håp om effekt av behandling kunne føre til uthalende intensiv behandling og utsettelse av formidling av dårlige nyheter. Intensiv behandling er mer vanlig for barn og unge voksne (rundt 50%) og fører til dårlig kvalitet på den siste tiden. Opptil 85% ønsker å få dø hjemme. Også her er kommunikasjon nøkkelen, og viktigheten av å koble inn palliative team og lage gode planer ble understreket. Vi trenger bevissthet og følsomhet i møte med disse pasientene.
Icro Meattini fra Firenze holdt et innholdsmettet foredrag om «Interaksjoner mellom systemisk behandling og strålebehandling». Det har kommet mange nye kreftmedisiner de siste åra, der noen er kjente radiosensitizers, og det foreligger en del studier. Men generelt foreligger lite data om kombinasjon med stråleterapi for svært mange av de virksomme nye medikamentene. Økt viten rundt interaksjoner kan kanskje være aktuelt tema for et senere OnkoNytt.
Yvette van der Linden og Joanne van der Velden, begge fra Nederland, holdt avslutningsforedraget om behandling av kompliserte beinmetastaser. De ukompliserte er de som gir smerter, men er uten truende eller påvist fraktur, og uten kompresjon av medulla eller cauda equina (uavhengig av metastasens størrelse). Her er anbefalingen 8 Gy x1 (level 1 evidens). Men hva med de kompliserte? En lesjon kan skåres med hensyn til kompleksitet på bakgrunn av lokalisasjon, smertegrad og lesjonens utseende og hvor mye den involverer av knokkelens diameter. De viste hvordan det også i palliative situasjoner er nyttig med multidisiplinære beslutninger, hvor nevrologiske funn, lesjonens beliggenhet og pasientens allmenntilstand veies opp mot onkologiske behandlingsmuligheter og behov for stabiliserende tiltak (NOMS framework). Slik kan en metastase i Th11 ende opp med behandlingsmulighetene 8 Gy x 1, 3 Gy x 10, eller stereotaksi med 18 Gy x 1, alt etter totalsituasjon.
En pasient kan være ute av stand til å motta en behandling vi er i stand til å gi
Alle onkologer, uansett subspesialitet, vil møte den palliative pasienten. Som ellers gjelder det å finne riktig tiltak til riktig tid. En pasient kan være ute av stand til å motta en behandling vi er i stand til å gi.
Denne dagen – og starten på mitt ESTRO 23 – ble en vakker påminnelse om hva som er viktig i møte med våre pasienter og deres nære og kjære. Omsorg for hele mennesket betyr at vi også anerkjenner det ikke rent fysiske, at vi er lyttende og seende, at vi utnytter våre tekniske behandlingsmuligheter på en klok måte. Vi fikk presentert prognostiske verktøy som kan bevisstgjøre oss med tanke på forventet levetid, og stereotaksi er allerede godt etablert i palliativ strålebehandling. Palliativ strålebehandling innebærer ofte rebestråling, og det gjøres og planlegges kartlegginger for tryggere estimering av kumulative doser. De mange foredragene inneholdt interessante referanser, som jeg gjerne deler.