Elin Aamdal. Lege i spesialisering og stipendiat ved Avdeling for kreftbehandling, Oslo Universitetssykehus
Elin Aamdal
Immunterapi er blitt omtalt som den nye behandlingsmodaliteten for kreft, og det snakkes om et paradigmeskifte innenfor kreftbehandling (1). Særlig gjelder dette en type medikamenter som på engelsk kalles immune checkpoint inhibitors, på norsk immunologiske sjekkpunkthemmere eller kontrollpunkthemmere, som i løpet av kort tid har endret behandlingsmuligheter og prognoser ved flere alvorlige kreftsykdommer.
Foreløpig vet vi mest om bruken av dem ved inoperabelt melanom, en sykdom som tidligere er blitt betegnet som uhelbredelig, men hvor det nå fins evidens for langtidsoverlevelse. Enkelte hevder at disse pasientene er kurert fra sin sykdom (2). Imidlertid er det god dokumentasjon for effekt ved behandling av metastatisk ikke-småcellet lungecancer (NSCLC), klarcellet nyrecellecarcinom og som adjuvant behandling etter kirurgi for stadium III melanom, indikasjoner som nå er godkjent av Food and Drug Administration (FDA) for bruk av sjekkpunkthemmer. I tillegg er det lovende resultater i tidlige kliniske studier for flere andre kreftsykdommer, og utprøving pågår nå på et bredt spekter av cancerdiagnoser, inkludert kombinasjoner med kjemoterapi, strålebehandling, målrettet behandling og andre typer immunterapi. Denne artikkelen er et forsøk på å gi en klinisk oversikt over et felt i hastig utvikling.
Immunologisk sjekkpunkt
Et immunologisk sjekkpunkt kan defineres som et protein eller signalvei som under vanlige fysiologiske forhold er nødvendig for å vedlikeholde immunologisk selvtoleranse og justere varighet og kaliber av immunrespons for å minimere skade i eget vev (3). Tumorceller vet å utnytte seg av dette og kan oppnå immunologisk toleranse ved å påvirke ekspresjon av slike sjekkpunkter. Med utgangspunkt i hva som i dag er klinisk relevant dreier terapeutisk hemming av sjekkpunkter seg om å modulere den antigen-spesifikke T-celle responsen ved å fremme co-stimulerende signaler eller motvirke hemmende signaler. Mange kontrollpunkter er identifisert, og det oppdages stadig flere.
CTLA-4
Jim Allison et.al beskrev på 90-tallet kontrollpunktet cytotoksisk T-lymfocytt-assosiert antigen 4 (CTLA-4)/CD28/B7 og genererte et antistoff som kunne blokkere CTLA-4 (4). CTLA-4 uttrykkes på aktiverte T-celler. I tillegg til antigen-presentasjon avhenger T-celle respons av et co-stimuli mediert via B7, uttrykt på antigen-presenterende celler, som binder seg til CD28, uttrykt på T-celler. CTLA-4 har en høyere affinitet for liganden B7 enn CD28 og nedregulerer dermed T-celle aktivering ved å hemme det nødvendige tilleggssignalet. Dette skjer sentralt og tidlig i en immunrespons, og blir ofte referert til som en brems grunnet et skifte mot nedregulering av CD4+ hjelper- og CD8+ effektor-celler mot en oppregulering av immunsupprimerende CD4+25+ regulatoriske T-celler. Hemming av CTLA-4 faciliterer videre T-celle aktivering ved å unngå denne immunnedreguleringen som ellers finner sted og er også sett å depletere regulatoriske T-celler i tumor mikromiljø. Ytterligere virkningsmekanismer kan ikke utelukkes.
Terapeutisk CTLA-4 blokkade
Langtidsoverlevelse ved CTLA-4 hemmer i metastatisk melanom
Ipilimumab (Yervoy®) er et human monoklonalt IgG (G1) antistoff som hemmer CTLA-4. I en randomisert fase 3-studie med 676 pasienter med inoperabelt melanom ble ipilimumab 3mg/kg IV hver 3.uke, totalt 4 kurer, testet mot peptidvaksinen gp100 eller kombinasjonen i mangel på standardbehandling ved denne diagnosen (5). Studien var den første til å vise økt median overlevelse ved metastatisk melanom (hhv. 10.1 mnd ved ipilimumab, 6.4 mnd ved gp100 og 10.0 mnd ved ipilimumab+gp100). 2-års overlevelse var også til fordel for ipilimumab monoterapi (23.5%, vs. 21.6% ipilimumab+gp100 vs. 13.7% gp100). Dette var bakgrunnen for at FDA godkjente ipilimumab på indikasjonen metastatisk melanom i 2011. Overlevelsesdata fra 4242 melanom-pasienter i tidligere fase-2/3 studier og ”expanded-access”-programmer for ipilimumab viste median overlevelse på 9.5 mnd og en 3 års overlevelse på 20-26% avhengig av eventuell tidligere behandling (6-7). Follow-up var inntil 10 år, og man observerte et platå av overlevelseskurven fra omkring 3 år som holdt seg stabilt, hvilket er indikativt for langtidsoverlevelse. En slik effekt er tidligere ikke observert i denne pasientgruppen.
Bivirkninger ved CTLA-4 hemmer
I nevnte fase-3 studie rapporterte 22.9% grad 3-4 bivirkninger som ble vurdert medikamentrelatert (5). De vanligste bivirkningene inkluderte utslett/kløe, fatigue kvalme, diaré og anoreksi. Et nytt spekter med inflammatoriske bivirkninger ble tidlig beskrevet og kjent som immun-relaterte bivirkninger (8). Hodi et al.(5) rapporterte grad 3-4 immun-relaterte bivirkninger hos 14.5% hos gruppen som fikk ipilimumab monoterapi. En senere rapport om livskvalitet fra denne studien fant ingen signifikant negativ påvirkning i ipilimumab-armene i behandlingsperioden (9).
Reinduksjon med ipilimumab kan vurderes ved senere progresjon hvis det tidligere var ikke-progressiv sykdom i minimum 3 måneder etter første behandlingsrunde og eventuell toksisitet ikke innebar behandlingsavbrudd eller var av alvorlig grad. Det fins foreløpig kun dokumentasjon fra studier med et begrenset antall pasienter, men disse rapporterer sykdomskontroll hos inntil 2/3 av pasientene, og det er ikke sett økt toksisitet ved rebehandling (10-11). Virkningsmekanismen ved ny respons er ikke kjent, men mulige teorier går ut på at det kan være en forsterking av allerede etablert immunrespons, eventuelt at sykdomsprogresjon kan gi opphav til nytt antigenreportoir som ikke er gjenkjent av eksisterende T-celle populasjon, men at rebehandling kan ekspandere nye T-celle kloner spesifikke for nye antigener (11). Det er ikke publisert data for effekt av ipilimumab etter PD-1 hemmer i større studier, men foreløpige resultater fra en studie som ser på sekvensert behandling med nivolumab og ipilimumab var i favør av denne rekkefølgen (12).
Adjuvant behandling med ipilimumab etter regional lymfeknutedisseksjon for stadium III melanom er nylig blitt godkjent av FDA på bakgrunn av en fase-3 EORTC studie med 951 pasienter som viste signifikant høyere median residivfri overlevelse i behandlingsarmen (26.1 mnd vs.17.1) (13). Pasienter ble randomisert til placebo eller ipilimumab 10 mg/kg hver 3. uke, totalt 4 kurer og deretter hver 3. mnd opp til 3 år. Toksisitet var imidlertid nokså uttalt med grad 3-4 bivirkninger rapportert hos 54% i behandlingsarmen og 25% i placeboarmen. 49% av pasientene i ipilimumab-gruppen måtte avslutte behandling grunnet medikamentrelaterte bivirkninger og kun 7% fullførte hele behandlingsprogrammet. 1% (5 pasienter) døde som følger av behandlingsrelaterte bivirkninger inkludert colitt, myocarditt og Guillain-Barré syndrom.
CTLA-4 hemming ved andre kreftsykdommer
De fleste kliniske studier med CTLA-4 hemmer har fokusert på melanomer av kutan opprinnelse. Det fins begrenset litteratur når det gjelder uvealt melanom og melanom med utgangspunkt i slimhinner, men sykdomsstabilisering inkludert komplette responser er rapportert (14-15). For prostatakreft så det initialt lovende ut, men ipilimumab 10 mg/kg, men lykkes ikke å vise en signifikant bedring i overlevelse når sammenliknet med placebo etter strålebehandling i en fase 3-studie med 799 pasienter med metastatisk kastraksjonsrefraktær prostatacancer som progredierte etter docetaxel (16). CTLA-4 hemmeren tremelimumab er i tidlige kliniske studier vist å kunne indusere varige responser ved metastatisk melanom (17-18), men har ved en fase 3-studie ikke vist signifikant økt overlevelse mot DTIC (19). Akseptabel toksisitet og tilfeller av respons med CTLA-4 hemmer ved metastatisk sykdom er beskrevet i tidlige kliniske studier for mesotheliom (20), hepatocellulært carcinom(21), adenocarcinom i øvre GI-tractus (22) og sammen med gemcitabine 1000 mg/m2 for metastatisk pancreascancer (23). En fase-1 doseeskaleringsstudie med tremelimumab + sunitinib for metastatisk nyrekreft viste en responsrate på 43%, men uttalt toksisitet i form av akutt nyresvikt ble observert hos flere pasienter (24). CTLA-4 antistoff har i tidlige kliniske studier ikke lykkes med å vise kliniske resultater ved flere kreftsykdommer også inkludert lungecancer (25-28).
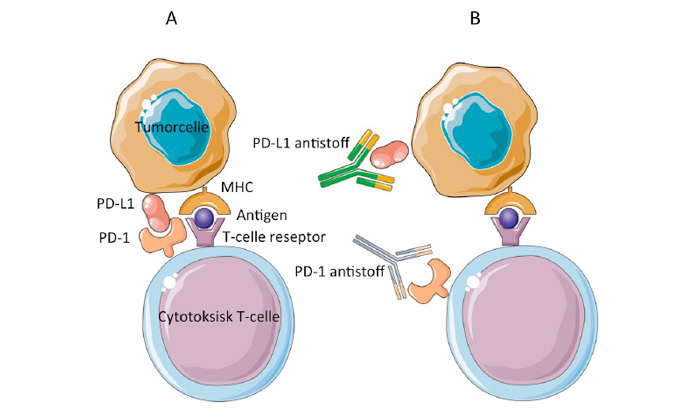
PD-1/PD-L1
PD-1 (Programmed Death-1) er et annet immunregulerende protein uttrykt på mange tumorinfiltrerende T-celler. Sammen med ligandene PD-L1 og PD-L2 danner PD-1 et immun sjekkpunkt. PD-L1 uttrykkes og oppreguleres ofte på tumorceller og celler i tumor mikromiljø hvor den supprimerer cytokinproduksjon og aktivitet til PD1+ tumorinfiltrerende CD4+ og CD8+ T celler. PD-L2 uttrykkes primært på antigenpresenterende celler. Effekten av PD-1/PD-L1-blokkade er altså lokal i tumor, i motsetning til ved CTLA-4 hemmer, hvor den systemiske effekten er dominerende. Antistoffer mot liganden PD-L1 er også utviklet, men bruk er i dag kun som del av protokollerte studier.
Terapeutisk PD-1/PD-L1 blokkade
Hemming av interaksjonen PD-1/PD-L1 interaksjonen har vist gode resultater ved flere kreftsykdommer. Også her er melanom en foregangssykdom, men det er god dokumentasjon for effekt ved flere andre cancere. Follow-up er kortere enn ved ipilimumab da PD-1 hemmer har vært kortere i klinisk bruk, men data tyder på langtidsoverlevelse, med en utflating av halen av kurven. To antistoffer som blokkerer denne interaksjonen har hittil blitt godkjent av FDA, nemlig de humane monoklonale (IgG4) PD-1 antistoffene pembrolizumab (Keytruda®) og nivolumab (Opdivo®). Det er ennå uvisst hvor lenge behandling med PD-1 hemmer er nødvendig for optimal respons, men praksis er at behandling gis kontinuerlig hver 2.-3.uke i inntil 2 år med mindre det er progresjon eller toksisitet som krever seponering. Bivirkninger ved PD-1 antistoffer er generelt mindre hyppige og uttalte enn ved CTLA-4 blokkade, med færre rapporterte behandlingsrelaterte dødsfall, og omfatter fatigue, asteni, muskel- og skjelettsmerter, feber, anoreksi, kvalme, diaré, hudutslett, pneumonitt, kreatininforhøyelse og hypotyreose (29-33). Som ved ipilimumab kan i prinsippet alle organer affiseres. Kliniske resultater for PD-1/PD-L1 hemmere ved ulike cancerdiagnoser er summert nedenfor.
Melanom
Det foreligger god dokumentasjon for behandlingseffekt av PD-1 hemmer ved inoperabelt melanom. I 2014 godkjente FDA nivolumab og pembrolizumab for behandlingsrefraktær metastatisk melanom.
I en studie ble 418 tidligere ubehandlede pasienter med BRAF vill-type metastatisk melanom randomisert til behandling med nivolumab 3 mg/kg hver 2.uke + placebo eller DTIC 1000 mg/m2 hver 3.uke + placebo (32). 1-års overlevelse og PFS var begge signifikant høyere i nivolumab-gruppen (72.9% vs. 42.1% og 5.1 mnd vs. 2.2 mnd). Responsraten var 40 % i nivolumab-armen mot 13.9% i DTIC-armen. Bedre overlevelse ved nivolumab enn ved DTIC ble sett ved alle subgrupper, og i tillegg var toksisitet høyere i kjemoterapi-armen (17.6% vs. 11.7% grad 3-4 bivirkninger).
I en stor fase 1-studie med 173 pasienter som hadde progrediert etter ipilimumab, ble pasienter randomisert til behandling med pembrolizumab 2 mg/kg eller 10 mg/kg hver 3. uke (30). Det var ingen signifikant forskjell mellom toksisitet og responsrater (26%) i de to behandlingsgruppene. Respons var sett å være langvarig, median varighet ikke nådd. Median PFS var 22 uker for pembrolizumab 2 mg/kg og 14 uker for 10 mg/kg hvilket indikerer at det her ikke nødvendigvis eksisterer et dose-respons forhold.
I en fase 3-studie ble 834 pasienter med avansert melanom randomisert til pembrolizumab 10 mg/kg hver 2.uke, pembrolizumab 10 mg/kg hver 3.uke og ipilimumab 3 mg/kg hver 3.uke (29). Klinisk nytteverdi var lik i begge pembrolizumab-armene. Både 6 måneders-PFS og 1-års overlevelse var signifikant til fordel for pembrolizumab (hhv. 46.4-47.3% vs. 26.5% og 68.4-74.1% vs. 58.2%). Median overlevelse var ikke nådd i noen av studiearmene. Toksisitet var lavere ved behandling med begge doser pembrolizumab enn ved ipilimumab. Behandling med nivolumab 3 mg/kg hver 2.uke mot DTIC 1000 mg/m2 hver 3.uke ved metastatisk melanom etter progresjon på ipilimumab, eller ipilimumab og BRAF hemmer ved BRAF mutert sykdom, har i en randomisert, kontrollert fase 3-studie med 405 pasienter vist en signifikant høyere responsrate (38% vs. 5%) (33). I nivolumab-armen var median varighet av respons ikke nådd, og 87% av responsene var varige på analysetidspunktet. Ekspresjon av PD-L1 i svulstvev var forbundet med høyere responsrate, men det ble også sett effekt i pasienter med svulster som ikke uttrykket PD-L1. Det var ingen forskjell i PFS i intention-to-treat analyse (4.7 vs. 4.2 mnd). Grad 3-4 toksisitet var vanligere ved nivolumab(12% vs. 9%).
I en interim-analyse av en randomisert fase-II studie utført i en lignende populasjon ble 540 pasienter randomisert til pembrolizumab 2 mg/kg, pembrolizumab 10 mg/kg eller klinikers valg av kjemoterapi (31). Det var ved analyse av data 48% crossover fra kjemoterapi-armen til pembrolizumab. Risiko for død eller progresjon var signifikant lavere ved pembrolizumab enn ved kjemoterapi (HR 0.57 ved 2 mg/kg og HR 0.50 ved 10 mg/kg). Det var ingen signifikant forskjell i PFS mellom gruppene (2.9 i begge pembrolizumab-armene vs. 2.7 i kjemoterapi-armen).
Data for total overlevelse forelå ikke på publikasjonstidspunktet. Grad 3-4 toksisitet var høyere i kjemoterapi-armen (26% vs. 14% i pembrolizumab 10 mg/kg og 11% i pembrolizumab 2 mg/kg).
Dette bekrefter tidligere data (36). Man så her en responsrate på 38% hvor 81% var pågående på analysetidspunktet.
Follow-up ved PD-hemmere er kortere enn ved ipilimumab, men oppfølging av 107 tidligere tungt behandlede pasienter som mottok nivolumab som del av en fase 1 doseeskalieringsstudie har vist 62% 1-års overlevelse og 43% 2-årsoverlevelse (34), altså bedre enn ved ipilimumab.
Respons etter reinduksjon med PD1 antistoff ved metastatisk melanoma er beskrevet (35). Studier med adjuvant PD-1 hemmer etter kirurgi for stadium III melanom er pågående.
NSCLC
PD-1 hemmer er blitt brukt kortere ved lungecancer enn ved melanom, men det foreligger også her god dokumentasjon.
Tidlige kliniske studier med nivolumab i ulike doseringer ved pulmonalt plateepitelcarsinom har vist responsrater på 14.5-17%, hvor flere av disse var varige (37-38). 1-,2- og 3-års overlevelse ved 3 mg/kg, dosen brukt ved fase-3 studier, er rapportert hhv. 56%, 42% og 27% (38). Grad 3-4 toksisitet er rapportert hos 14-17% og er av lignende karakter som sett ved melanom, men med mulig høyere forekomst av pneumonitt.
En randomisert fase 3-studie har vist økt median overlevelse ved inoperabelt plateepitelcarcinom med nivolumab 3 mg/kg hver 2.uke sammenlignet med docetaxel 75 mg/m2 hver 3.uke (9.2 vs. 6.0 mnd) når gitt etter tidligere platin-holdig kjemoterapi (39). Risiko for død var 41% mindre med nivolumab (HR 0.59). Det var dessuten betydelig forskjell i 1-års overlevelse (24% ved docetaxel vs. 42% ved nivolumab.) Responsrater lå signifikant høyere for nivolumab (20% vs. 9%) og median varighet av respons for nivolumab var ikke nådd ved publikasjon. Det var ingen forskjell i responsrater mellom svulster med høyt og lavt nivå av PD-L1. Det vil si liten nytte av PD-L1 som biomarkør. Det var rapportert lavere toksisitet i nivolumab-armen. Studien førte til at nivolumab i 2015 ble FDA-godkjent som behandling for plateepitelcarsinom etter progresjon på platin-basert kjemoterapi.
En senere randomisert fase 3 studie med nivolumab 3 mg/kg hver 2.uke mot docetaxel 75 mg/m2 hver 3.uke med 582 pasienter med NSCLC med annen histologi enn plateepitelcarcinom og progresjon etter platin-holdig kjemoterapi viste signifikant lengre median overlevelse ved nivolumab enn ved docetaxel (12.2 mnd vs.9.4 mnd) (40).
PFS var imidlertid signifikant høyere i docetaxel-armen enn i nivolumab-armen (2.3 mnd vs. 4.2 mnd), men 1-års progresjonsfri overlevelse var signifikant høyere ved nivolumab (19% vs. 8%), hvilket illustrerer at PFS er et mindre egnet endepunkt ved immunterapi studier. 1-års overlevelse var signifikant høyere ved nivolumab (51% vs. 39%). Ved PD-L1 negative tumorer, ble det ikke sett signifikant forskjell i overlevelse mellom de to behandlingsarmene. Toksisitet var høyere i kjemoterapi-armen. Studien ledet til en utvidelse av FDA-godkjennelsen for nivolumab til også å involvere NSCLC-pasienter av annen histologi enn platepitelcarsinom.
Pembrolizumab 2 mg/kg eller 10 mg/kg hver 3.uke eller 10 mg/kg hver 2.uke ble undersøkt i en studie med 495 pasienter med NSCLC hvor majoriteten tidligere hadde mottatt behandling (41). Grad 3-4 toksisitet ble rapportert hos 9.5% av pasientene og var av samme art som ved nivolumab. Median overlevelse var 12.0 mnd. Responsraten var 19.4%, og median varighet av respons var 12.5 mnd. Man fant at PD-L1 var av nytte som biomarkør da det var høyere responsrate ved PD-L1 positive svulster. Median overlevelse var i denne subgruppen ikke nådd. Studien førte til at pembrolizumab i 2015 ble godkjent av FDA i 2.linje for non-småcellet lungecancer sammen med en diagnostisk test som analyserer PD-L1 ekspresjon i tumor.
Nyrekreft
Nivolumab ble nylig godkjent av FDA til bruk ved metastatisk klarcellet nyrecancer etter progresjon på angiogenesehemmer. Dette var basert på en randomisert fase 3-studie som viste en signifikant overlevelsesgevinst på 5.4 mnd til fordel for nivolumab 3 mg/kg hver 2.uke mot everolimus 10 mg/dag (25.0 vs.19.6 mnd) (42). Studien omfattet 821 pasienter med klarcellet nyrecancer som tidligere hadde mottatt angiogenesehemmer. Responsrate ble observert høyere ved nivolumab (25 % vs. 5%). Det ble beskrevet færre grad 3-4 bivirkninger i nivolumab-armen (19% vs.37%), og disse var av samme type som tidligere beskrevet ved PD-1 blokkade. Klinisk nytte ble observert uavhengig av PD-L1 ekspresjon. Varige responser >3 år etter avsluttet nivolumab-behandling inkludert 3-års overlevelse på 44% er beskrevet ved tidligere studier (43-44).
Blærekreft
PD-L1-antistoffet MPDL3280A har i en fase 1-studie med 68 tidligere behandlede pasienter med metastatisk blærekreft vist en respons hos 17 pasienter, hvorav 2 i komplett remisjon (45). Alle responser med unntak av én var varige på analysetidspunktet. Sannsynlighet for respons var høyere ved økt PD-L1 ekspresjon.
3% rapporterte behandlingsrelaterte grad 3 bivirkninger, ingen grad 4 toksisistet ble observert.
Ovariekreft
I en basket-studie hvor pasienter med ulike diagnoser mottok PD-L1 antistoff responderte 6% (1), mens 18% (3) hadde stabil sykdom
som var varig ved analysetidspunkt (46). En fase 2-studie med 20 pasienter med platinresistente ovariecancer av blandet histologi som ble behandlet med nivolumab 1 mg/kg eller 3 mg/kg viste akseptabel toksisitet. Tre pasienter responderte, hvorav to gikk i komplett remisjon (3 mg/kg). 45% oppnådde sykdomskontroll. PD-L1 ekspresjon ble ikke funnet å være signifikant korrelert med respons (47).
Colorektalcancer
Varig respons etter behandling med PD-1 hemmer er observert (43), men effekt av PD-L1/PD-L1 blokkade i colorektalcancer har i tidlige studier generelt vært skuffende (46).
Pembrolizumab 10 mg/kg hver 2.uke viste i en fase-2 studie omfattende 41 pasienter med metastatisk progredierende colorektalcancer med og uten mikrosatelitt ustabilitet og defekt misparringsreparasjon (MSI-H og dMMR) responsrater på hhv. 40% og 0% (48). Median PFS ble ikke nådd i gruppen med MSI-H/dMMR, men i gruppen uten var denne 2.2 mnd.
Defekt misparringsreparasjon opptrer i en liten fraksjon av colorektalcancere og var assosiert med et betydelig høyere gjennomsnittlig antall somatiske mutasjoner enn de “mismatch”-reparasjonsinntakte (1782 vs. 73), noe som er blitt relatert til denne subgruppens høye immunogenisitet og T-celle infiltrasjon i tumor mikromiljø.
Ventrikkelcancer
I en fase 1b studie ble 39 PD-L1+ pasienter med residiv av adenokarsinom i ventrikkel behandlet med pembrolizumab 10 mg/kg (49). Grad 3-4 toksisitet ble sett hos 3 pasienter og behandlingsrespons var sett hos 12 pasienter, hvorav 11 var varige ved 6 mnd follow-up.
Hodgkin´s lymfom
I en fase 1-studie fikk 23 tungt førbehandlede pasienter med residiv av Hodgkins lymfom nivolumab 3mg/kg hver 2.uke til komplett respons, progresjon eller toksisitet som gjorde at de måtte avslutte behandling. Studien viste en responsrate på 87%. Fire pasienter hadde komplett remisjon. De tre pasientene som ikke ble definert som respondere hadde stabil sykdom. Median antall kurer var 16 (6-37).To pasienter avsluttet behandling grunnet toksisitet (50).
Hode- og halskreft
Responsrate på 20% ved residiverende plateepitelcarcinom i hode- og halsregionen ble rapportert for pembrolizumab 10 mg/kg hver 2.uke (51). Responsraten var høyere hos de PD-L1+ tumorer (45.5% vs. 11.4%). Lignende resultater er sett i en annen basket-studie med PD-L1 antistoff (52). I ekspansjonsarmen av førstnevnte studie ble en fast dose på pembrolizumab 200 mg IV gitt hver 3.uke til 132 pasienter med residiv av plateepitelcarcinom i hode- og halsregionen (53). Grad 3-4 toksisitet ble observert hos 7.6%. Responsrate var 18.2%. 31.3% hadde stabil sykdom.
Trippel negativ brystkreft
Resultater fra en fase 1b-studie omfattende 27 tidligere tungt behandlede pasienter med PD-L1+ metastatisk trippel negativ brystkreft som fikk pembrolizumab 10 mg/kg hver 2.uke viste en responsrate på 18.5%, inkludert en komplett remisjon (54). Median PFS lå under 2 måneder, men hos respondere lå responsvarighet på 40 uker eller mer. Det var ingen sammenheng mellom respons og grad av PD-L1 uttrykk i tumor. Toksisitet var som ved andre studier med PD-1 blokkade. Et behandlingsrelatert dødsfall ble rapportert. Tidlige data fra en fase 1-studie omfattende PD-L1 hemmer hos 54 pasienter med metastatisk trippel negative brystkreft viste god toleranse og en objektiv responsrate på 19%, hvor ¾ var pågående responser (55).
Kombinasjonsbehandling
Mange studier utforsker nå om ulike kombinasjonsbehandlinger kan gi additiv eller synergistisk respons ved ulike diagnosegrupper. Strålebehandling og enkelte typer kjemoterapi gir cytogen celledød, hvilket kan være immunmodulerende blant annet ved frigjøring av antigener og suppresjon av regulatoriske T celler. Dette gir et godt rasjonale for kombinasjonsbehandling med sjekkpunkthemmer. I tillegg kan man argumentere for at lengre tid til eventuell respons ved sjekkpunktblokkade er vanligere enn ved flere andre typer tumorrettet behandling, og derfor gjør kombinasjoner med medikamenter med raskere innsettende responser interessante.
Også her foreligger det mest dokumentasjon når det gjelder metastatisk melanom.
Kombinasjonen DTIC 850 mg/m2 og ipilimumab 10 mg/kg viste i en randomisert fase 3-studie en overlevelsesgevinst til pasienter som mottok kombinasjonsbehandling mot DTIC 850 mg/m2 monoterapi (11.2 mnd vs. 9.1 mnd), men forskjellen var sannsynligvis ikke signifikant høyere enn ved ipilimumab alene (56). Grad 3-4 toksisitet ble beskrevet hos 56% som fikk kombinasjonsbehandling og 27.5% i DTIC-armen. Levertoksisitet var noe høyere enn sett ved tidligere studier.
Kombinasjonen fotemustine 100 mg/m2 og ipilimumab 10 mg/kg gav sykdomskontroll hos 46.5% av pasientene i en fase 2-studie, inkludert pasienter med hjernemetastaser (57). Betydelig økt toksisitet, særlig benmargstoksisitet og levertoksisitet ble observert.
Kombinajonen bevacizumab/ipilimumab er utforsket i en fase 2 dose-eskaleringsstudie hvor man så begrenset toksisitet og median overlevelse på 25.1 mnd (58).
Vemurafenib + ipilimumab 3 mg/kg ble undersøkt i en fase 1-studie, men studien ble stanset tidlig grunnet flere tilfeller grad 3-4 hepatitt (59).
Dette ble ikke sett når ipilimumab ble kombinert med dabrafenib, men tillegg av MEK-hemmeren trametinib til dabrafenib/ ipilimumab førte til uttalt colitt i flere pasienter, og studien ble derfor stoppet tidlig (60).
Ipilimumab/IL-2 kombinasjonen er i tidlige kliniske studier vist å øke antall komplett respondere og gi lang varighet av respons med akseptabel bivirkningsprofil (61).
En fase 1-studie av pegylert interferon alfa2b kombinert med ipilimumab viste en responsrate på omkring 42% og var godt tolerert med unntak av økt forekomst av grad 3 hudutslett (62).
Kombinasjonen GM-CSF og ipilimumab mot ipilimumab monoterapi ble undersøkt i en randomisert fase 2-studie med 245 pasienter (63). Man fant økt overlevelse til fordel for kombinajonen (17.5 mnd vs. 12.7 mnd) med færre bivirkninger i kombiasjonsgruppen.
Talimogen laherparevec (Imlygic ®) , også kjent som T-VEC, er nylig godkjent av FDA for melanom med metastaser til hud og lymfeknuter. T-VEC injiseres i kutane eller subkutane metastaser og består av genmodifisert herpes simplex virus-1 konstruert for selektivt å replisere og forårsake onkolyse i tumorceller samt å frigjøre GM-CSF. I tillegg til direkte effekt i tumor bidrar derfor T-VEC også til en systemisk effekt. I en fase 1b-studie ble T-VEC kombinert med ipilimumab 3 mg/kg (79). Av de 18 pasientene som mottok behandling ble grad 3-4 bivirkninger beskrevet hos 32%. Responsraten var 41%, hvor noe under halvparten oppnådde komplett remisjon.
Peptidvaksinen gp100 var i kombinasjon med ipilimumab ikke sett å øke overlevelse i denne gruppen (5).
Ved Utprøvingsenheten, Avdeling for kreftbehandling, Oslo Universitetssykehus pågår aktuelt en studie med ipilimumab 3 mg/kg kombinert med telomerase-peptidvaksinen UV1.
Noe av det mest imponerende av resultater når det gjelder kombinasjonsbehandling er uten tvil kombinasjonen ipilimumab/nivolumab i metastatisk melanom. Rasjonalet bak kombinasjon av sjekkpunkthemmer er nettopp ulik virkningsmekanisme med ipilimumab som virker sentralt i lymfeknuter med å gjenopprette og opprettholde T-celle aktivering og nivolumab virkende perifert med å unngå nøytralisering av cytotoksiske T-celler ved PD-L1+ tumorceller og PD-L2+ dendritiske celler i tumor mikromiljø.
I en trearmet fase 3-studie ble 945 tidligere ubehandlede pasienter randomisert til nivolumab 3 mg/kg hver 2.uke + placebo, nivolumab 1 mg/kg + ipilimumab 3 mg/kg hver 3.uke eller ipilimumab 3 mg/kg hver 3.uke + placebo (65). Grad 3-4 toksisitet ble rapportert i hhv. i16.3%, 55.0% og 27.3%. Toksisteten var av samme art som ved kombinasjonsbehandling, men altså mer hyppig enn ved monoterapi-armene lagt sammen. 38.3% av pasientene i kombinasjonsarmen avsluttet behandling grunnet toksisitet. Median progresjonsfri overlevelse var 6.9 mnd i nivolumab-armen, 11.5 mnd i kombinasjonsarmen og 2.9 mnd i ipilimumab-armen. For PD-L1- tumorer viste kombinasjonsbehandling bedre median progresjonsfri overlevelse enn ved nivolumab eller ipilimumab alene (hhv.11.2 mnd, 5.3 mnd. og 2.8 mnd). Denne forskjellen ble ikke sett for PD-L1+ tumorer, men studien hadde ikke styrke til en formell statistisk sammenligning mellom nivolumab monoterapi-gruppen og kombinasjonsgruppen. Objektiv respons var høyere i kombinasjonsarmen (57.6% vs. 43.7% ved nivolumab og 19.0% ved ipilimumab), og median varighet av respons var ikke nådd.
En lignende objektiv responsrate for ble observert i en tidligere randomisert dobbelt-blindet studie som sammenlignet kombinasjonen nivolumab 1 mg/kg og ipilimumab 3 mg/kg med ipilimumab 3 mg/kg og placebo hos 145 pasienter med metastatisk melanom (66). Dette inkluderte komplett respons hos 22% i kombinasjonsarmen, men ingen i ipilimumab monoterapi-armen. Median varighet av respons var heller ikke her nådd. Toksisitet var også av lignende grad. 3 behandlingsrelaterte dødsfall ble rapportert i kombinasjonsgruppen mot ingen i ipilimumab-gruppen. Selv om kun 40% i kombinasjonsarmen fortsatte med nivolumab etter fullført ipilimumab-behandling, hadde 68% av disse klinisk respons som var pågående. Studiens primære endepunkt var responsrate i BRAF villtype melanom (61%), og selv om det ble observert lignende responsrate for BRAF muterte melanom (52%), har
FDA foreløpig kun godkjent kombinasjonsbehandling for BRAF villtype melanom.
Fase-3 studien fant lignende PFS ved BRAF mutert sykdom som ved BRAF villtype (11.7 vs.11.2 mnd) (65). Data for total overlevelse foreligger ennå ikke i disse studiene, men en fase-1 studie med ipilimumab/nivolumab med 4 ulike doseringskohorter hos 53 pasienter har vist 1 og 2 års overlevelse på hhv. 82% og 75% på tvers av kohortene (67). Kombinasjonsbehandling gir en høyere responsrate enn ved sekvensert behandling av CTLA-4 og PD-1 sjekkpunkt-blokkade, men også høyere toksisitet (68).
I en fase 1-studie med 90 pasienter med inoperabelt stadium III-IV melanom ble ulike doser nivolumab kombinert med en multipeptid vaksine. Kombinasjonen var godt tolerert med en responsrate på 25%, hvor varighet på opptil 140 uker ble observert (69).
I en fase-1 studie ble ulike doser av nivolumab og en multipeptid-(gp100, MART-1, NY-ESO-1, Montanide ISA 51 VG) vaksine gitt til 33 HLA-A*0201 positive pasienter etter kirurgi for stadium III-IV sykdom. Kombinasjonen ble vurdert å ha akseptabel toksisitet. Overlevelse kunne ikke vurderes på analysetidspunktet (70).
Preliminære resultater fra en fase 1/2-studie omfattende 19 pasienter med metastatisk nyrekreft eller melanom behandlet med pembrolizumab 2 mg/kg + lavdose ipilimumab 1 mg/kg eller pembrolizumab 2 mg/kg + pegylert interferon alfa-2b viste doselimiterende toksisitet hos 6 pasienter (71). Responsrate og overlevelsesdata forelå ikke, men behandlingseffekt var sett hos begge diagnosegrupper. Det er mange pågående studier med PD-1 hemmer i kombinasjon med ulike typer kreftbehandling for flere diagnosegrupper.
Utfordringer ved sjekkpunktblokkade
Immun-relaterte bivirkninger
Immun-relaterte bivirkninger kan i prinsippet affisere alle organer. Når det gjelder ipilimumab, dreier det seg hovedsakelig om kløe/utslett, colitt, hepatitt og endokrine bivirkninger som hypofysitt, thyroiditt og binyrebarksvikt, men episcleritt, uveitt, pancreatitt, myocarditt og nevropatier er også beskrevet (72).
Disse bivirkningene observeres også ved PD-1 blokade, men i mindre grad enn ved ipilimumab. Særlig gjelder dette colitt og hypofysitt. Pneumonitt er i liten grad rapportert ved CTLA-4 hemmer og er på lik linje med andre immun-relaterte bivirkninger sett å respondere godt på kortikosteroider.
Immun-relaterte bivirkninger kan forklares med redusert toleranse av egne antigener og er blitt relatert til CD4+ og CD8+ T-celle infiltrasjon samt cytokinfrigjøring (73).
Tidligere mente man det var en sammenheng mellom immun-relaterte bivirkninger og respons, men en analyse av pasienter som hadde fått ipilimumab 10 mg/kg i 3 ulike fase II studier fant ingen signifikant sammenheng (74). Debut er som regel første 12 uker av behandling, men kan også opptre senere (75).
Typisk gjelder dette hypofysitt som kan være vanskelig å diagno-stisere klinisk grunnet noe uspesifikke symptomer, men bør mistenkes ved allmennsymptomer som fatigue, feber, hypotensjon, samt elektrolyttforstyrrelser, arytmier, endringer i synsfelt, hodepine, kvalme og oppkast. Målrettet blodprøvetaking med tanke på hypothalamus-hypofyseaksen og MR caput bør gjennomføres ved mistanke. Ved bekreftet diagnose bør pasienten henvises endokrinolog for videre oppfølging.
Tidligere visste man mindre om hvordan slike bivirkninger bør håndteres, men mortaliteten tilknyttet behandling er i senere studier lavere, sannsynligvis grunnet økt oppmerksomhet omkring dette (76).
Man ser at tett oppfølging med tidlig kontakt til helsevesenet og rask igangsettelse av behandling kan begrense omfanget. Spesielt gjaldt det colitter, og pasienter med diaré (75). De fleste immun-relaterte bivirkninger opphører spontant eller kan håndteres med steroider under langsom nedtrapping og vil klinge av i løpet av noen uker (75). De endokrine bivirkningene er i større grad sett å kunne vedvare. Guidelines for håndtering av disse bivirkningene er utviklet (77).
Avhengig av alvorlighetsgrad er den generelle regelen symptomatisk behandling, og ved behov orale kortikosteroider evt. høy-dose IV kortikosteroider, deretter gradvis nedtrapping over minimum en 4-ukers periode. Ved manglende effekt kan det spesielt ved colitt være nødvendig med ytterligere behandling som TNFα-antistoffet infliximab (Remicade®) og i spesielle tilfeller kirurgi.
Akutt kortikosteroid-substitusjon kan være påkrevd ved Addisons krise og behovet kan være livslangt (76). Tidligere mente man at den immunsupprimmerende effekten av corticosteroider ville motvirke behandlingsrespons, men etterhvert er det blitt tydeligere at kortikosteroider oppstartet etter behandling nok i mindre grad påvirker respons. Profylaktisk oral budesonid ved ipilimumab 10 mg/kg ble i en randomisert studie observert ikke signifikant å påvirke verken overlevelse eller grad 2-4 diaré (78). Tidligere ipilimumab-relatert toksisitet ble ikke sett å være relatert til toksisitet ved senere nivolumab (33).
Kjent autoimmun sykdom er vanligvis et eksklusjonskriterium for sjekkpunkthemmer grunnet frykt for forverring av tilstanden. Det foreligger svært begrenset dokumentasjon for bruk av sjekkpunkthemmer i denne settingen, men enkeltkasuistikker har vist at ipilimumab-behandling ikke har forårsaket forverring av autoimmun sykdom når gitt samtidig med immunmodulerende behandling av grunnsykdommen, samt at dette også kan resultere i behandlingsrespons (79).
Det er dokumentasjon for at ipilimumabbehandling er godt tolerert hos eldre (80). Det er omstridt hvorvidt høyere doser (10 mg/kg) gir bedre effekt, men toksisitet er rapportert høyere (81).
Vurdering av behandlingseffekt
Som beskrevet i flere av nevnte studier sees objektiv responsrate som vurdert ved RECIST i mindre grad å reflektere overlevelsen og er derfor lite egnet som endepunkt ved bruk av sjekkpunkthemmer.
Som eksempel kan nevnes tidligere siterte fase 3-studie som omfattet ipilimumab vs. gp100 vs kombinasjonen (5). Objektiv responsrate var omkring 11% i ipilimumab monoterapi-armen, inkludert 2 komplette responser, og var i mindre grad sett å gjenspeile overlevelse (23.5% ved 24 mnd) 10.
Det er observert stor heterogenitet i responsmønstre (82). Fire responstyper er beskrevet og kan relateres til gunstigere overlevelse inkludert (a) en reduksjon i baseline lesjoner uten nytilkomne lesjoner; (b) varig stabil sykdom (hos enkelte pasienter etterhvert langsom tilbakegang av tumorbyrde); (c) respons etter initial økende tumorbyrde og (d) respons av baseline lesjoner med tilkomne nye lesjoner (83). Dette kan delvis forklares med at mobilisering av immunrespons tar tid, og reell tumorvekst vil derfor kunne skje. I tillegg vil infiltrasjon av immunceller kunne gi økende tumorstørrelse. Selv nye lesjoner kan være synlig radiologisk uten at det nødvendigvis er snakk om progresjon.
Denne tendensen sees også ved PD-1 hemmer (84). Dette var bakgrunnen for at man definerte immun-relaterte radiologiske responskriterier (iRRC), en modifisert variant av Response Evaluation Criteria In Solid Tumors (RECIST), som tar høyde for at responsen for immunoonkologisk behandling har en annen kinetikk enn kjemoterapi (83). Disse vil allikevel ikke kunne fange opp hele omfanget av respondere.
Tidspunkt for første evaluering er vanligvis 12 uker etter behandlingsstart. Imidlertid er tid til respons også høyst variabelt med partielle responser rapportert så sent som i uke 52 og komplette responser rapportert uke 48 for ipilimumab (85).
Respons ved PD-1 hemmer synes å komme noe raskere, men er rapportert så sent som uke 36 (30). Dette innebærer at pasienter med svært utbredt sykdom må kunne ”tåle” å vente noen måneder på behandlingsrespons. Imidlertid er det vanskelig å bruke dette i praksis da pasienter med svært utbredt sykdom også responderer på sjekkpunkt-blokkade.
Biomarkører
Til tross for omfattende forskning er ingen klinisk brukbar prediktiv biomarkør identifisert hverken for bruk med CTLA-4 hemmer eller PD-1/PD-L1-hemmer.
Analyser av prognostiske faktorer som tumorbyrde, LD, CRP og BRAF-status har ikke vært entydige i forhold til å predikere behandlingsrespons av sjekkpunkthemmer. En rekke studier har sett på immunologiske markører som absolutt antall lymfocytter i perifert blod, tumorinfiltrerende lymfocytter, antigen-spesifikke responser, CD45RO+ T hukommelsesceller, regulatoriske T-celler, ICOS, IDO og MDSC ved ulike diagnoser uten at det her heller er klare resultater.
Særlig er PD-L1 ekspresjon i tumor mye omtalt. PD-L1 ekspresjon er vist å reflektere et immunologisk aktivt mikromiljø (86), men gode resultater er også rapportert hos pasienter som er vurdert PD-L1 negative (32). Ved noen diagnoser, som ikke-småcellet lungecancer, har imidlertid enkelte studier vist at PD-L1 uttrykk i tumor er mer prediktivt for behandlingseffekt enn ved for eksempel melanom. Det eksisterer ikke konsensus omkring ”cut-off” for PD-L1 positivitet, og mye tyder på at dette er en heterogent uttrykt dynamisk markør. I tillegg er det sannsynlig at samspillet i immunsystemet er mer komplekst enn dette og at andre faktorer spiller inn. Ingen genetisk markør er så langt observert å kunne predikere behandlingseffekt. Median antall somatiske mutasjoner er sett høyest ved cancere som melanom og NSCLC (87). Det er sannsynlig at disse mutasjonene gjør tumorceller mer immunogene. Immunterapi generelt, inkludert sjekkpunkthemmere, har vist bedre effekt ved immunogene cancere, men også i disse gruppene er variasjonen stor.
Genetiske, og immunologiske faktorer blir omtalt som de mest lovende kandidater til mulige biomarkører, men det er for tidlig å si om en enkel prediktiv markør vil kunne identifiseres. Monitorering av immunologisk respons fra blod er fortsatt i eksperimentelle stadier.
Tilgang i Norge
Tilgang til PD-1 hemmere har i Norge inntil nylig vært begrenset til kliniske studier og compassionate use-programmer.
Helsemyndighetene har argumentert for at det foreligger begrenset dokumentasjon ved sjekkpunktblokkade for flere indikasjoner, noe det med bakgrunn i refererte studier er vanskelig å være enig i. Imidlertid er prisen høy og begrepet finansiell toksisitet er blitt introdusert.
I Norge har helsemyndighetene per i dag ikke godkjent kostnadsrefusjon av ipilimumab. Behandlingen ble i 2013 vurdert som ikke kostnadseffektiv av Helsedirektoratet basert på beregning av kvalitetsjusterte leveår (QUALYs). Endelig avslag kom mars 2013 og ble begrunnet med at prisen per QUALY var høyere enn det som vanligvis vurderes kostnadseffektivt. Imidlertid besluttet daværende helseminister Jonas Gahr Støre kort tid etter å bevilge 100 millioner kroner til en forskningsstudie omfattende ipilimumab ved metastatisk melanom (Ipi4-studien). Dette sikret tilgang til ipilimumab for 100 norske pasienter.
Etter at de planlagte 100 pasientene ble inkludert i studien ble det ved Beslutningsforums møte 20.10.14 besluttet at inntil resultat av metodevurderingene for behandling ved metastatisk melanom forelå, skulle bruk av ipilimumab ved inoperabelt malignt melanom kontinueres og tas inn i nasjonale retningslinjer. I praksis betyr dette at det enkelte helseforetaket dekker kostnadene per pasient. Ipi4-studien ble utvidet til å rekruttere 50 ytterligere pasienter og lukket for inklusjon våren 2015. Etter dette har behandling fortsatt etter samme retningslinjer.
En fullstendig metodevurdering av behandling ved malignt melanom er nylig publisert publisert ved Kunnskapssenteret. Ipilimumab ble som de andre behandlingene i rapporten ikke vurdert kostnadseffektiv med apotekets maksimale utsalgspris, mens forhandlinger om pris ved nivolumab og pembrolizumab endret dette, og medførte at disse to omsider er blitt innvilget refusjon av Beslutningsforum for metastatisk melanom.
Situasjonen er per i dag uavklart når det gjelder bruk av ipilimumab monoterapi og kombinasjonsbehandling med nivolumab ved metastatisk melanom. Det samme gjelder ipilimumab adjuvant etter kirurgi for stadium III melanom, nivolumab ved metastatisk NSCLC og klarcellet nyrecancer og pembrolizumab ved NSCLC.
Oppsummering
Immun sjekkpunktblokkade har gitt signifikant økt overlevelse i randomiserte studier ved inoperabelt melanom, metastatisk NSCLC og metastatisk nyrecancer. Follow-up av behandlede melanompasienter tyder på langtidsoverlevelse og muligvis kurasjon hos enkelte.
Kombinasjonsbehandling med CTLA-4 og PD-1 hemmer i metastatisk melanom har vist svært gode resultater i tidlige studier, og det er høye forventninger til videre overlevelsesdata fra pågående fase 3-studie.
Videre har adjuvant behandling med ipilimumab etter kirurgi vist økt progresjonsfri overlevelse ved stadium III melanom.
Tidlige kliniske studier viser lovende resultater for PD-1 hemmere også ved flere andre kreftsykdommer.
Fremtiden synes å være i kombinasjonsbehandling hvor det nå pågår en rekke studier på tvers av cancerdiagnoser, også cancere tidligere ikke tenkt på som immunogene. Utfordringer ligger i å identifisere akseptable doser, tidsintervaller og behandlingsvarighet for å optimalisere effekt.
Det er usikkert hvorvidt klinisk nyttige prediktive markører vil bli identifisert. Flere nye sjekkpunkter er identifisert som terapeutiske mål, for eksempel LAG-3, VISTA, CD160, BTLA, OX40 og TIM3. Dette er et område i hastig utvikling, og det er sannsynlig at denne artikkelen ikke er oppdatert på publikasjonstidspunktet.
Referanser
- Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science. 2013 Dec 20;342(6165):1432-3.
- Eggemont AM, Maio M, Robert C. Immune Checkpoint Inhibitors in Melanoma Provide the Cornerstones for Curative Therapies. Semin Oncol 2015; 42 (3): 429–435.
- Pardol DM. FOCUS ON: Tumour immunology & immunotherapy. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer 2012; 12, 252-264.
- J Exp Med. 1995 Aug 1;182(2):459-65.CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. Krummel MF1, Allison JP.
- Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, Gonzalez R, Robert C, Schadendorf D, Hassel JC, Akerley W, van den Eertwegh AJ, Lutzky J, Lorigan P, Vaubel JM, Linette GP, Hogg D, Ottensmeier CH, Lebbé C, Peschel C, Quirt I, Clark JI, Wolchok JD, Weber JS, Tian J, Yellin MJ, Nichol GM, Hoos A, Urba WJ. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010; 363(8): 711-23.
- Schadendorf D, Hodi FS, Robert C, Weber JS, Margolin K, Hamid O, Patt D, Chen TT, Berman DM, Wolchok JD. Pooled Analysis of Long-Term Survival Data From Phase II and Phase III Trials of Ipilimumab in Unresectable or Metastatic Melanoma. J Clin Oncol. 2015 ; 33(17): 1889-94.
- Maio M, Grob JJ, Aamdal S, Bondarenko I, Robert C, Thomas L, Garbe C, Chiarion-Sileni V, Testori A, Chen TT, Tschaika M, Wolchok JD. Five-year survival rates for treatment-naive patients with advanced melanoma who received ipilimumab plus dacarbazine in a phase III trial. J Clin Oncol. 2015; 33(10):1191-6.
- Weber J. Review: anti-CTLA-4 antibody ipilimumab: case studies of clinical response and immune-related adverse events. Oncologist. 2007;12(7):864-72.
- Revicki DA, van den Eertwegh AJ, Lorigan P, Lebbe C, Linette G, Ottensmeier CH, Safikhani S, Messina M, Hoos A, Wagner S, Kotapati S. Health related quality of life outcomes for unresectable stage III or IV melanoma patients receiving ipilimumab treatment. Health Qual Life Outcomes. 2012; 10:66.
- Robert C, Schadendorf D, Messina M, Hodi FS, O’Day S; MDX010-20 investigators. Efficacy and safety of retreatment with ipilimumab in patients with pretreated advanced melanoma who progressed after initially achieving disease control. Clin Cancer Res. 2013;19(8):2232-9.
- Chiarion-Sileni V. Ipilimumab retreatment in patients with pretreated advanced melanoma: the expanded access programme in Italy. Br J Cancer 2014; 110: 1721-26.
- Presentert ved ESMO av Hodi FS 27.9.15. An open-label, randomized, phase 2 study of nivolumab (NIVO) given sequentially with ipilimumab (IPI) in patients with advanced melanoma (CheckMate 064).
- Eggermont AM, Chiarion-Sileni V, Grob JJ, Dummer R, Wolchok JD, Schmidt H, Hamid O, Robert C, Ascierto PA, Richards JM, Lebbé C, Ferraresi V, Smylie M, Weber JS, Maio M, Konto C, Hoos A, de Pril V, Gurunath RK, de Schaetzen G, Suciu S, Testori A. Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. Lancet Oncol. 2015; 16(5):522-30.
- Luke JJ1, Callahan MK, Postow MA, Romano E, Ramaiya N, Bluth M, Giobbie-Hurder A, Lawrence DP, Ibrahim N, Ott PA, Flaherty KT, Sullivan RJ, Harding JJ, D’Angelo S, Dickson M, Schwartz GK, Chapman PB, Wolchok JD, Hodi FS, Carvajal RD. Clinical activity of ipilimumab for metastatic uveal melanoma: a retrospective review of the Dana-Farber Cancer Institute, Massachusetts General Hospital, Memorial Sloan-Kettering Cancer Center, and University Hospital of Lausanne experience. Cancer. 2013;119(20):3687-95.
- Postow MA, Luke JJ, Bluth MJ, Ramaiya N, Panageas KS, Lawrence DP, Ibrahim N, Flaherty KT, Sullivan RJ, Ott PA, Callahan MK, Harding JJ, D’Angelo SP, Dickson MA, Schwartz GK, Chapman PB, Gnjatic S, Wolchok JD, Hodi FS, Carvajal RD. Ipilimumab for patients with advanced mucosal melanoma. Oncologist. 2013;18(6):726-32.
- Kwon ED, Drake CG, Scher HI, Fizazi K, Bossi A, van den Eertwegh AJ, Krainer M, Houede N, Santos R, Mahammedi H, Ng S, Maio M, Franke FA, Sundar S, Agarwal N, Bergman AM, Ciuleanu TE, Korbenfeld E, Sengeløv L, Hansen S, Logothetis C, Beer TM, McHenry MB, Gagnier P, Liu D, Gerritsen WR; CA184-043 Investigators. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol. 2014; 15(7):700-12.
- Camacho LH, Antonia S, Sosman J, Kirkwood JM, Gajewski TF, Redman B, Pavlov D, Bulanhagui C, Bozon VA, Gomez-Navarro J, Ribas A. Phase I/II trial of tremelimumab in patients with metastatic melanoma. J Clin Oncol. 2009; 27(7):1075-81.
- Phase II trial of tremelimumab (CP-675,206) in patients with advanced refractory or relapsed melanoma.Kirkwood JM1, Lorigan P, Hersey P, Hauschild A, Robert C, McDermott D, Marshall MA, Gomez-Navarro J, Liang JQ, Bulanhagui CA. Clin Cancer Res. 2010;16(3):1042-8.
- Phase III randomized clinical trial comparing tremelimumab with standard-of-care chemotherapy in patients with advanced melanoma.Ribas A, Kefford R, Marshall MA, Punt CJ, Haanen JB, Marmol M, Garbe C, Gogas H, Schachter J, Linette G, Lorigan P, Kendra KL, Maio M, Trefzer U, Smylie M, McArthur GA, Dreno B, Nathan PD, Mackiewicz J, Kirkwood JM, Gomez-Navarro J, Huang B, Pavlov D, Hauschild A. J Clin Oncol. 2013; 31(5):616-22.
- Calabrò L, Morra A, Fonsatti E, Cutaia O, Amato G, Giannarelli D, Di Giacomo AM, Danielli R, Altomonte M, Mutti L, Maio M. Tremelimumab for patients with chemotherapy-resistant advanced malignant mesothelioma: an open-label, single-arm, phase 2 trial. Lancet Oncol. 2013;14(11):1104-11.
- Sangro B, Gomez-Martin C, de la Mata M, Iñarrairaegui M, Garralda E, Barrera P, Riezu-Boj JI, Larrea E, Alfaro C, Sarobe P, Lasarte JJ, Pérez-Gracia JL, Melero I, Prieto J. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C. J Hepatol. 2013; 59(1):81-8.
- Ralph C, Elkord E, Burt DJ, O’Dwyer JF, Austin EB, Stern PL, Hawkins RE, Thistlethwaite FC. Modulation of lymphocyte regulation for cancer therapy: a phase II trial of tremelimumab in advanced gastric and esophageal adenocarcinoma. Clin Cancer Res. 2010; 16(5):1662-72.
- Aglietta M, Barone C, Sawyer MB, Moore MJ, Miller WH Jr, Bagalà C, Colombi F, Cagnazzo C, Gioeni L, Wang E, Huang B, Fly KD, Leone F. A phase I dose escalation trial of tremelimumab (CP-675,206) in combination with gemcitabine in chemotherapy-naive patients with metastatic pancreatic cancer. Ann Oncol. 2014;25(9):1750-5.
- Rini BI, Stein M, Shannon P, Eddy S, Tyler A, Stephenson JJ Jr, Catlett L, Huang B, Healey D, Gordon M. Phase 1 dose-escalation trial of tremelimumab plus sunitinib in patients with metastatic renal cell carcinoma. Cancer 2011; 117(4): 758-67.
- Lynch TJ, Bondarenko I, Luft A, Serwatowski P, Barlesi F, Chacko R, Sebastian M, Neal J, Lu H, Cuillerot JM, Reck M. Ipilimumab in Combination With Paclitaxel and Carboplatin As First-Line Treatment in Stage IIIB/IV Non–Small-Cell Lung Cancer: Results From a Randomized, Double-Blind, Multicenter Phase II Study. J Clin Oncol. 2012; 30(17):2046-54.
- Ipilimumab in combination with paclitaxel and carboplatin as first-line therapy in extensive-disease-small-cell lung cancer: results from a randomized, double-blind, multicenter phase 2 trial.Reck M1, Bondarenko I, Luft A, Serwatowski P, Barlesi F, Chacko R, Sebastian M, Lu H, Cuillerot JM, Lynch TJ. Ann Oncol. 2013 Jan;24(1):75-83.
- Vonderheide RH, LoRusso PM, Khalil M, Gartner EM, Khaira D, Soulieres D, Dorazio P, Trosko JA, Rüter J, Mariani GL, Usari T, Domchek SM. Tremelimumab in combination with exemestane in patients with advanced breast cancer and treatment-associated modulation of inducible costimulator expression on patient T cells. Clin Cancer Res. 2010; 16(13): 3485-94.
- Chung KY, Gore I, Fong L, Venook A, Beck SB, Dorazio P, Criscitiello PJ, Healey DI, Huang B, Gomez-Navarro J, Saltz LB. Phase II study of the anti-cytotoxic T-lymphocyte-associated antigen 4 monoclonal antibody, tremelimumab, in patients with refractory metastatic colorectal cancer. J Clin Oncol. 2010; 28(21):3 485-90.
- Robert C, Schachter J, Long GV, Arance A, Grob JJ, Mortier L, Daud A, Carlino MS, McNeil C, Lotem M, Larkin J, Lorigan P, Neyns B, Blank CU, Hamid O, Mateus C, Shapira-Frommer R, Kosh M, Zhou H, Ibrahim N, Ebbinghaus S, Ribas A. Pembrolizumab versus Ipilimumab in Advanced Melanoma.; KEYNOTE-006 investigators. N Engl J Med. 2015; 372(26): 2521-32.
- Robert C, Ribas A, Wolchok JD, Hodi FS, Hamid O, Kefford R, Weber JS, Joshua AM, Hwu WJ, Gangadhar TC, Patnaik A, Dronca R, Zarour H, Joseph RW, Boasberg P, Chmielowski B, Mateus C, Postow MA, Gergich K, Elassaiss-Schaap J, Li XN, Iannone R, Ebbinghaus SW, Kang SP, Daud A. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet. 2014; 384(9948): 1109-17.
- 31. Ribas A, Puzanov I, Dummer R, Schadendorf D, Hamid O, Robert C, Hodi FS, Schachter J, Pavlick AC, Lewis KD, Cranmer LD, Blank CU, O’Day SJ, Ascierto PA, Salama AK, Margolin KA, Loquai C, Eigentler TK, Gangadhar TC, Carlino MS, Agarwala SS, Moschos SJ, Sosman JA, Goldinger SM, Shapira-Frommer R, Gonzalez R, Kirkwood JM, Wolchok JD, Eggermont A, Li XN, Zhou W, Zernhelt AM, Lis J, Ebbinghaus S, Kang SP, Daud A. Pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory melanoma (KEYNOTE-002): a randomised, controlled, phase 2 trial. N Engl J Med. 2015; 372(26):2521-32.
- 32. Robert C, Long GV, Brady B, Dutriaux C, Maio M, Mortier L, Hassel JC, Rutkowski P, McNeil C, Kalinka-Warzocha E, Savage KJ, Hernberg MM, Lebbé C, Charles J, Mihalcioiu C, Chiarion-Sileni V, Mauch C, Cognetti F, Arance A, Schmidt H, Schadendorf D, Gogas H, Lundgren-Eriksson L, Horak C, Sharkey B, Waxman IM, Atkinson V, Ascierto PA. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med. 2015; 372(4):320-30.
- 33. Weber JS, D’Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns B, Hoeller C, Khushalani NI, Miller WH Jr, Lao CD, Linette GP, Thomas L, Lorigan P, Grossmann KF, Hassel JC, Maio M, Sznol M, Ascierto PA, Mohr P, Chmielowski B, Bryce A, Svane IM, Grob JJ, Krackhardt AM, Horak C, Lambert A, Yang AS, Larkin J. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2015; 16(8):908-18.
- Survival, Durable Tumor Remission, and Long-Term Safety in Patients With Advanced Melanoma Receiving Nivolumab. Topalian SL, Sznol M, McDermott DM, Kluger HM, Carvajal RD, Sharfman WH, Brahmer JR, Lawrence DP, Atkins MB, Powderly JD, Leming PD, Lipson EJ, Puzanov I, Smith DC, Taube JM, Wigginton JM, Kollia GD, Gupta A, Pardoll DM, Sosman JA and Hodi FS. J Clin Oncol. 2014;32(10):1020-30.
- Lipson EJ, Sharfman WH, Drake CG, Wollner I, Taube JM, Anders RA, Xu H, Yao S, Pons A, Chen L, Pardoll DM, Brahmer JR, Topalian SL. Durable cancer regression off-treatment and effective reinduction therapy with an anti-PD-1 antibody. Clin Cancer Res. 2013; 19(2):462-8.
- Hamid O, Robert C, Daud A, Hodi FS, Hwu WJ, Kefford R, Wolchok JD, Hersey P, Joseph RW, Weber JS, Dronca R, Gangadhar TC, Patnaik A, Zarour H, Joshua AM, Gergich K, Elassaiss-Schaap J, Algazi A, Mateus C, Boasberg P, Tumeh PC, Chmielowski B, Ebbinghaus SW, Li XN, Kang SP, Ribas A. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N Engl J Med. 2013; 369(2):134-44.
- Rizvi NA, Mazières J, Planchard D, Stinchcombe TE, Dy GK, Antonia SJ, Horn L, Lena H, Minenza E, Mennecier B, Otterson GA, Campos LT, Gandara DR, Levy BP, Nair SG, Zalcman G, Wolf J, Souquet PJ, Baldini E, Cappuzzo F, Chouaid C, Dowlati A, Sanborn R, Lopez-Chavez A, Grohe C, Huber RM, Harbison CT, Baudelet C, Lestini BJ, Ramalingam SS. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial Lancet Oncol. 2015;16(3):257-65.
- Gettinger SN, Horn L, Gandhi L, Spigel DR, Antonia SJ, Rizvi NA, Powderly JD, Heist RS, Carvajal RD, Jackman DM, Sequist LV, Smith DC, Leming P, Carbone DP, Pinder-Schenck MC, Topalian SL, Hodi FS, Sosman JA, Sznol M, McDermott DF, Pardoll DM, Sankar V, Ahlers CM, Salvati M, Wigginton JM, Hellmann MD, Kollia GD, Gupta AK, Brahmer JR. Overall Survival and Long-Term Safety of Nivolumab (Anti-Programmed Death 1 Antibody, BMS-936558, ONO-4538) in Patients With Previously Treated Advanced Non-Small-Cell Lung Cancer. J Clin Oncol. 2015;33(18):2004-12.
- Brahmer J, Reckamp KL, Baas P, Crinò L, Eberhardt WE, Poddubskaya E, Antonia S, Pluzanski A, Vokes EE, Holgado E, Waterhouse D, Ready N, Gainor J, Arén Frontera O, Havel L, Steins M, Garassino MC, Aerts JG, Domine M, Paz-Ares L, Reck M, Baudelet C, Harbison CT, Lestini B, Spigel DR. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med. 2015;373(2):123-35.
- Borghaei H, Paz-Ares L, Horn L, Spigel DR, Steins M, Ready NE, Chow LQ, Vokes EE, Felip E, Holgado E, Barlesi F, Kohlhäufl M, Arrieta O, Burgio MA, Fayette J, Lena H, Poddubskaya E, Gerber DE, Gettinger SN, Rudin CM, Rizvi N, Crinò L, Blumenschein GR Jr, Antonia SJ, Dorange C, Harbison CT, Graf Finckenstein F, Brahmer JR. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015;373(17):1627-39.
- Garon EB1, Rizvi NA, Hui R, Leighl N, Balmanoukian AS, Eder JP, Patnaik A, Aggarwal C, Gubens M, Horn L, Carcereny E, Ahn MJ, Felip E, Lee JS, Hellmann MD, Hamid O, Goldman JW, Soria JC, Dolled-Filhart M, Rutledge RZ, Zhang J, Lunceford JK, Rangwala R, Lubiniecki GM, Roach C, Emancipator K, Gandhi L; KEYNOTE-001 Investigators. Pembrolizumab for the treatment of non-small-cell lung cancer. N Engl J Med. 2015;372(21):2018-28.
- Motzer RJ, Escudier B, McDermott DF, George S, Hammers HJ, Srinivas S, Tykodi SS, Sosman JA, Procopio G, Plimack ER, Castellano D, Choueiri TK, Gurney H, Donskov F, Bono P, Wagstaff J, Gauler TC, Ueda T, Tomita Y, Schutz FA, Kollmannsberger C, Larkin J, Ravaud A, Simon JS, Xu LA, Waxman IM, Sharma P; CheckMate 025 Investigators.. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015; 373(19):1803-13.
- Lipson EJ, Sharfman WH, Drake CG, Wollner I, Taube JM, Anders RA, Xu H, Yao S, Pons A, Chen L, Pardoll DM, Brahmer JR, Topalian SL. Durable cancer regression off-treatment and effective reinduction therapy with an anti-PD-1 antibody. Clin Cancer Res. 2013 ; 19(2):462-8.
- McDermott DF, Drake CG, Sznol M, Choueiri TK, Powderly JD, Smith DC, Brahmer JR, Carvajal RD, Hammers HJ, Puzanov I, Hodi FS, Kluger HM, Topalian SL, Pardoll DM, Wigginton JM, Kollia GD, Gupta A, McDonald D, Sankar V, Sosman JA, Atkins MB.Survival, Durable Response, and Long-Term Safety in Patients With Previously Treated Advanced Renal Cell Carcinoma Receiving Nivolumab. J Clin Oncol. 2015; 20;33(18):2013-20.
- Powles T, Eder JP, Fine GD, Braiteh FS, Loriot Y, Cruz C, Bellmunt J, Burris HA, Petrylak DP, Teng SL, Shen X, Boyd Z, Hegde PS, Chen DS, Vogelzang NJ. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature. 2014 Nov 27;515(7528):558-62.
- Brahmer JR, Tykodi SS, Chow LQ, Hwu WJ, Topalian SL, Hwu P, Drake CG, Camacho LH, Kauh J, Odunsi K, Pitot HC, Hamid O, Bhatia S, Martins R, Eaton K, Chen S, Salay TM, Alaparthy S, Grosso JF, Korman AJ, Parker SM, Agrawal S, Goldberg SM, Pardoll DM, Gupta A, Wigginton JM. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med. 2012; 366(26):2455-65.
- Hamanishi J. Safety and Antitumor Activity of Anti–PD-1 Antibody, Nivolumab, in Patients With Platinum-Resistant Ovarian Cancer. JCO JCO.2015.62.3397; published online ahead of print on September 8, 2015.
- Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, Skora AD, Luber BS, Azad NS, Laheru D, Biedrzycki B, Donehower RC, Zaheer A, Fisher GA, Crocenzi TS, Lee JJ, Duffy SM, Goldberg RM, de la Chapelle A, Koshiji M, Bhaijee F, Huebner T, Hruban RH, Wood LD, Cuka N, Pardoll DM, Papadopoulos N, Kinzler KW, Zhou S, Cornish TC, Taube JM, Anders RA, Eshleman JR, Vogelstein B, Diaz LA Jr. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015; 372(26): 2509-20.
- Muro K, Bang Y, Shankaran V, et al. A phase 1b study of pembrolizumab (pembro; MK-3475) in patients with advanced gastric cancer. Annals Onc. 2014; Suppl 5:v1-v41.
- Ansell SM, Lesokhin AM, Borrello I, Halwani A, Scott EC, Gutierrez M, Schuster SJ, Millenson MM, Cattry D, Freeman GJ, Rodig SJ, Chapuy B, Ligon AH, Zhu L, Grosso JF, Kim SY, Timmerman JM, Shipp MA, Armand P.PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s lymphoma. N Engl J Med. 2015; 372(4):311-9.
- Seiwert TY, Weiss J, Gluck I, Eder JP, Pai SI, Dolled-Filhart M, Emancipator K, Pathiraja K, Gause C, Iannone R, Brown H, Houp J, Cheng JD, Chow LQM. A phase Ib study of MK-3475 in patients with human papillomavirus (HPV)-associated and non-HPV–associated head and neck (H/N) cancer. J Clin Oncol 32:5s 2014; (suppl; abstr 6011).
- Segal NH, Antonia SJ, Brahmer JR, Maio M, Blake-Haskins A, Li X, Vasselli J, Ibrahim RA, Lutzky J, Khleif S. Preliminary data from a multi-arm expansion study of MEDI4736, an anti-PD-L1 antibody. J Clin Oncol 32:5s, 2014 (suppl; abstr 3002^).
- Seiwert TY, Haddad RI, Gupta S, Mehra R, Tahara M, Berger R, Lee SH, Burtness B, Le DT, Heath K, Blum A, Dolled-Filhart M, Emancipator K, Pathiraja K, Cheng JD, Chow LQ. Antitumor activity and safety of pembrolizumab in patients (pts) with advanced squamous cell carcinoma of the head and neck (SCCHN): Preliminary results from KEYNOTE-012 expansion cohort. J Clin Oncol 33, 2015 (suppl; abstr LBA6008).
- Nanda R, Chow LQ, Dees EC, et al. A phase Ib study of pembrolizumab (MK-3475) in patients with advanced triple-negative breast cancer. Presented at the 2014 San Antonio Breast Cancer Symposium, December 9-13, 2014. San Antonio, Texas. Abstract S1-09.
- Emens LA, Braiteh FS, Cassier P, Delord JP, Eder JP, Fasso M, Xiao Y, Wang Y, Molinero L, Chen DS, Krop I. Inhibition of PD-L1 by MPDL3280A leads to clinical activity in patients with metastatic triple-negative breast cancer. 2015 AACR Annual Meeting. Abstract 2859. Presented April 20, 2015.12.04
- Robert C, Thomas L, Bondarenko I, O’Day S, Weber J, Garbe C, Lebbe C, Baurain JF, Testori A, Grob JJ, Davidson N, Richards J, Maio M, Hauschild A, Miller WH Jr, Gascon P, Lotem M, Harmankaya K, Ibrahim R, Francis S, Chen TT, Humphrey R, Hoos A, Wolchok JD.Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med. 2011;364:2517–26.
- Di Giacomo AM, Ascierto PA, Pilla L, Santinami M, Ferrucci PF, Giannarelli D, Marasco A, Rivoltini L, Simeone E, Nicoletti SV, Fonsatti E, Annesi D, Queirolo P, Testori A, Ridolfi R, Parmiani G, Maio MIpilimumab and fotemustine in patients with advanced melanoma (NIBIT-M1): an open-label, single-arm phase 2 trial. Lancet Oncol. 2012;13(9):879–86.
- Hodi FS, Lawrence D, Lezcano C, Wu X, Zhou J, Sasada T, Zeng W, Giobbie-Hurder A, Atkins MB, Ibrahim N, Friedlander P, Flaherty KT, Murphy GF, Rodig S, Velazquez EF, Mihm MC Jr, Russell S, DiPiro PJ, Yap JT, Ramaiya N, Van den Abbeele AD, Gargano M, McDermott D.Bevacizumab plus ipilimumab in patients with metastatic mela- noma. Cancer Immunol Res. 2014;2:632–42.
- Ribas A, Hodi FS, Callahan M, Konto C, Wolchok J. Hepatotoxicity with combination of vemurafenib and ipilimumab. N Engl J Med. 2013;368:1365–6.
- Minor DR1, Puzanov I2, Callahan MK3, Hug BA4, Severe gastrointestinal toxicity with administration of trametinib in combination with dabrafenib and ipilimumab.Pigment Cell Melanoma Res. 2015 Sep;28(5):611-2.
- Prieto PA1, Yang JC, Sherry RM, Hughes MS, Kammula US, White DE, Levy CL, Rosenberg SA, Phan GQ.CTLA-4 blockade with ipilimumab: long-term follow-up of 177 patients with metastatic melanoma. Clin Cancer Res. 2012; 18:2039–47.
- 77.Kudchadkar RR, Gibney GT, Dorman D, et al. A phase IB study of ipilimumab with peginterferon alfa-2b for patients with unresectable stages IIIB/C/IV melanoma. J Clin Oncol. 2014;32(5s): abstract 9098.
- Hodi FS, Lee S, McDermott DF, Rao UN, Butterfield LH, Tarhini AA, Leming P, Puzanov I, Shin D, Kirkwood JM.Ipilimumab plus sargramostim vs ipilimumab alone for treatment of metastatic melanoma: a randomized clinical trial. JAMA. 2014;312:1744–53.
- Puzanov I, Milhem MM, Andtbacka RH, et al. Primary analysis of a phase 1b multicenter trial to evaluate safety and efficacy of talimogene laherparepvec (T-VEC) and ipilimumab (ipi) in previously untreated, unresected stage IIIB-IV melanoma. J Clin Oncol. 2014;32(suppl): abstract 9092.
- Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, Schadendorf D, Dummer R, Smylie M, Rutkowski P, Ferrucci PF, Hill A, Wagstaff J, Carlino MS, Haanen JB, Maio M, Marquez-Rodas I, McArthur GA, Ascierto PA, Long GV, Callahan MK, Postow MA, Grossmann K, Sznol M, Dreno B, Bastholt L, Yang A, Rollin LM, Horak C, Hodi FS, Wolchok JD. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma..N Engl J Med. 2015;373(1):23-34.
- Postow MA, Chesney J, Pavlick AC, Robert C, Grossmann K, McDermott D, Linette GP, Meyer N, Giguere JK, Agarwala SS, Shaheen M, Ernstoff MS, Minor D, Salama AK, Taylor M, Ott PA, Rollin LM, Horak C, Gagnier P, Wolchok JD, Hodi FS. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma N Engl J Med. 2015 Jul 2;373(1):23-34. N Engl J Med. 2015 May; 372(21):2006-17.
- Sznol M, Kluger HM, Callahan MK, Postow MA, Gordon RA, Segal NH, Rizvi NA, Lesokhin AM, Atkins MB, Kirkwood JM, Bruke MM, Ralabate AL, Rivera AL, Kronenberg SA, Agunwamba B, Feely W, Hong Q, Krishnan S, Gupta AK, Wolchok JD; Survival, response duration, and activity by BRAF mutation (MT) status of nivolumab (NIVO, anti-PD-1, BMS-936558, ONO-4538) and ipilimumab (IPI) concurrent therapy in advanced melanoma (MEL). J Clin Oncol 32:5s, 2014 (suppl; abstr LBA9003^).
- Weber JS, D’Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns B, Hoeller C, Khushalani NI, Miller WH Jr, Lao CD, Linette GP, Thomas L, Lorigan P, Grossmann KF, Hassel JC, Maio M, Sznol M, Ascierto PA, Mohr P, Chmielowski B, Bryce A, Svane IM, Grob JJ, Krackhardt AM, Horak C, Lambert A Yang AS, Larkin J.Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2015;16(4):375-84.
- Weber JS, Kudchadkar RR, Yu B, Gallenstein D, Horak CE, Inzunza HD, Zhao X, Martinez AJ, Wang W, Gibney G, Kroeger J, Eysmans C, Sarnaik AA, Chen YA. Safety, efficacy, and biomarkers of nivolumab with vaccine in ipilimumab-refractory or -naive melanoma. J Clin Oncol. 2013;31(34):4311-8.
- Gibney GT, Kudchadkar RR, DeConti RC, Thebeau MS, Czupryn MP, Tetteh L, Eysmans C, Richards A, Schell MJ, Fisher KJ, Horak CE, Inzunza HD, Yu B, Martinez AJ, Younos I, Weber JS. Safety, correlative markers, and clinical results of adjuvant nivolumab in combination with vaccine in resected high-risk metastatic melanoma. Clin Cancer Res. 2015; 21(4): 712-20.
- Atkins MB, Choueiri, TK Hodi FS, Thompson JA, Hwu WJ, McDermott DF, Brookes M, Tosolini A, Ebbinghaus S, Yang Z, Gause CK, Perini RF, Ribas A.(MK-3475) plus low-dose ipilimumab (IPI) in patients (pts) with advanced melanoma (MEL) or renal cell carcinoma (RCC): Data from the KEYNOTE-029 phase 1 study. J Clin Oncol 33, 2015 (suppl; abstr 3009).
- Weber JS, Kahler KC, and Hauschild A. Management of Immune-Related Adverse Events and Kinetics of Response. J Clin Oncol 2012 30: 2691-2697.
- Hodi FS, Mihm MC, Soiffer RJ, Haluska FG, Butler M, Seiden MV, Davis T, Henry-Spires R, MacRae S, Willman A, Padera R, Jaklitsch MT, Shankar S, Chen TC, Korman A, Allison JP, Dranoff G. Biologic activity of cytotoxic T lymphocyte-associated antigen 4 antibody blockade in previously vaccinated metastatic melanoma and ovarian carcinoma patients. Proc Natl Acad Sci U S A 100:4712-4717, 2003.
- Lutzky J, Wolchok J, Hamid O, et al: Association between immune-related adverse events (irAEs) and disease control or overall survival in patients (pts) with advanced melanoma treated with 10 mg/kg ipilimumab in three phase II clinical trials. J Clin Oncol 27:469s, 2009 (suppl; abstr 9034).
- Weber JS, Dummer R, de Pril V, Lebbe ́ C, Hodi FS for the MDX010-20 Investigators. Patterns of Onset and Resolution of Immune-Related Adverse Events of Special Interest With Ipilimumab Detailed Safety Analysis From a Phase 3 Trial in Patients With Advanced Melanoma. Cancer 2013: 1675-1682.
- Weber JS, Kahler KC, Hauschild A. J Management of Immune-Related Adverse Events and Kinetics of Response With Ipilimumab. Clin Oncol 2012 30:2691-2697.
- www.norcrin.no/bivirkningshandtering/
- Weber J, Thompson JA, Hamid O, Minor D, Amin A, Ron I, Ridolfi R, Assi H, Maraveyas A, Berman D, Siegel J, O’Day SJ. A randomized, double-blind, placebo-controlled, phase II study comparing the tolerability and efficacy of ipilimumab administered with or without prophylactic budesonide in patients with unresectable stage III or IV melanoma. Clin Cancer Res 15:5591-5598, 2009 .
- Ipilimumab in patients with melanoma and autoimmune disease. Kyi C, Carvajal RD, Wolchok JD, Postow MA. Journal for Immunotherapy of Cancer 2014, 2:35
- Efficacy and safety of ipilimumab in elderly patients with pretreated advanced melanoma treated at Italian centres through the expanded access programme. Chiarion Sileni V, Pigozzo J, Ascierto PA, Grimaldi AM, Maio M, Di Guardo L, Marchetti P, de Rosa F, Nuzzo C, Testori A, Cocorocchio E, Bernengo MG, Guida M, Marconcini R, Merelli B, Parmiani G, Rinaldi G, Aglietta M, Grosso M, Queirolo P.Journal of Experimental & Clinical Cancer Research 2014, 33:30.
- Wolchok JD1, Neyns B, Linette G, Negrier S, Lutzky J, Thomas L, Waterfield W, Schadendorf D, Smylie M, Guthrie T Jr, Grob JJ, Chesney J, Chin K, Chen K, Hoos A, O’Day SJ, Lebbé C. Ipilimumab monotherapy in patients with pretreated advanced melanoma: A randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncol 11:155-164, 2010.
- Saenger YM, Wolchok JD. The heterogeneity of the kinetics of response to ipilimumab in metastatic melanoma: patient cases. Cancer Immun. 2008 Jan 17;8:1.
- Guidelines for the Evaluation of Immune Therapy Activity in Solid Tumors: Immune-Related Response Criteria . Wolchok JD, Hoos A, O’Day S, Weber JS, Hamid O, Lebbé C, Maio M, Binder M, Bohnsack O, Nichol G, Humphrey R, Hodi FS. Clin Cancer Res 2009;15(23):7412–20.
- Robert C, Ribas A, Wolchok JD, Hodi FS, Hamid O, Kefford R, Weber JS, Joshua AM, Hwu WJ, Gangadhar TC, Patnaik A, Dronca R, Zarour H, Joseph RW, Boasberg P, Chmielowski B, Mateus C, Postow MA, Gergich K, Elassaiss-Schaap J, Li XN, Iannone R, Ebbinghaus SW, Kang SP, Daud A. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet. 2014; 384(9948):1109-17.
- Weber JS, O’Day S, Urba W, Powderly J, Nichol G, Yellin M, Snively J, Hersh E. Phase I/II Study of Ipilimumab for Patients With Metastatic Melanoma. J Clin Oncol 2008; 26:5950-5956.
- Taube JM, Klein A, Brahmer JR, Xu H, Pan X, Kim JH, Chen L, Pardoll DM, Topalian SL, Anders RA. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy. Clin Cancer Res. 2014; 20(19):5064-74.
- Alexandrov LB, Nik-Zainal S, Wedge DC, Aparicio SA, Behjati S, Biankin AV, Bignell GR, Bolli N, Borg A, Børresen-Dale AL, Boyault S, Burkhardt B, Butler AP, Caldas C, Davies HR, Desmedt C, Eils R, Eyfjörd JE, Foekens JA, Greaves M, Hosoda F, Hutter B, Ilicic T, Imbeaud S, Imielinski M, Jäger N, Jones DT, Jones D, Knappskog S, Kool M, Lakhani SR, López-Otín C, Martin S, Munshi NC, Nakamura H, Northcott PA, Pajic M, Papaemmanuil E, Paradiso A, Pearson JV, Puente XS, Raine K, Ramakrishna M, Richardson AL, Richter J, Rosenstiel P, Schlesner M, Schumacher TN, Span PN, Teague JW, Totoki Y, Tutt AN, Valdés-Mas R, van Buuren MM, van ’t Veer L, Vincent-Salomon A, Waddell N, Yates LR; Australian Pancreatic Cancer Genome Initiative; ICGC Breast Cancer Consortium; ICGC MMML-Seq Consortium; ICGC PedBrain, Zucman-Rossi J, Futreal PA, McDermott U, Lichter P, Meyerson M, Grimmond SM, Siebert R, Campo E, Shibata T, Pfister SM, Campbell PJ, Stratton MR. Signatures of mutational processes in human cancer. Nature 500, 415–421 (2013).