Av Margrete Haram, overlege i radiologi ved St. Olavs hospital, og stipendiat ved Institutt for klinisk og molekylær medisin (NTNU)
En velkjent utfordring ved kreftbehandling er lavt opptak av kjemoterapi i tumorvev. For å oppnå en tilstrekkelig dose i tumor utsettes også kroppens friske celler for store mengder kjemoterapi. Bivirkninger begrenser dose- og behandlingsintensitet. Forskere ved NTNU, SINTEF og St.Olavs hospital har arbeidet preklinisk med å optimalisere opptaket av kjemoterapi i kreftsvulster ved hjelp av ultralyd og mikrobobler. Basert på lovende resultater skal ultralyd-forsterket opptak av kjemoterapi videreutvikles og styrkes i en klinisk studie ved kreftavdelingen ved St. Olavs hospital.
Forskninsgruppa som står bak planlegging av denne studien består av:
Catharina Davies, professor ved Institutt for fysikk, NTNU
Margrete Haram, stipendiat ved Institutt for klinisk og molekylær medisin, NTNU og overlege i radiologi, St.Olavs hospital
Eva Hofsli, 1. amanuensis og overlege i onkologi, NTNU/St.Olavs hospital
Steinar Lundgren, professor og overlege ved Kreftklinikken, NTNU/St.Olavs hospital
Åsmund Flobak, lege, sivilingeniør, postdoktor ved NTNU/St.Olavs hospital
Rune Hansen, sivilingeniør, forsker, ISB, NTNU
Ola Finneng Myhre, sivilingeniør, postdoktor, ISB, NTNU
Lars Slørdal, professor i farmakaologi, NTNU/St.Olavs hospital
Grethe Albrektsen, professor i medisinsk statistikk, NTNU
Stein-Martin T. Fagerland, cand. med, stipendiat ved institutt for fysikk, NTNU
Bjørn Atle Angelsen, professor i Biomedisinsk teknikk, NTNU
På bildet (fra venstre): Stein-Martin Tilrum Fagerland, Margrete Haram, Ola Finneng Myhre, Eva Hofsli, Rune Hansen, Catharina de Lange Davies, Steinar Lundgren, Åsmund Flobak
Bakgrunn
For å øke opptak av kjemoterapi i tumor må flere barrierer overkommes – barrierer som vi tror skyldes defekt vaskularisering, høy cellularitet i tumor, svekket lymfedrenasje og høyt interstitielt trykk.
Forskningsmiljøer i Norge har hatt gjort en rekke gjennombrudd på dette feltet de siste årene. Ultralyd kombinert med mikrobobler har vist seg å være en lovende måte å øke opptak og distribusjon av nanomedisin på over biologiske barrierer. Snipstad et al ved Institutt for Fysikk ved NTNU har vist at ultralyd-indusert kavitering og kollaps av mikrobobler resulterte i signifikant økning i opptak og distribusjon av kjemoterapi-bærende nanopartikler i solide tumores. Det økte opptaket viste seg å føre til komplett og stabil remisjon av musemodeller for brystkreft med subkutant transplanterte svulster (xenograft).
En klinisk studie utført ved Haukeland sykehus av Dimcevski et al har allerede gitt oppløftende resultater. I tidsrommet januar 2012 – november 2013 ble det rekruttert 10 pasienter med inoperabelt adenokarcinom i pancreas. I tillegg til konvensjonell behandling med Gemcitabine (etter datidens retningslinjer) mottok disse også eksperimentell tilleggsbehandling med Sonovue ultralydbobler og fokusert ultralyd ved bruk av kommersielt tilgjengelig utstyr utviklet for diagnostikk. Sammenlignet med historiske data økte median overlevelse fra 8.9 måneder til 17,6 måneder.
Målet med den nye NTNU-initierte kliniske studien er å undersøke om fokusert ultralyd og mikrobobler kombinert med konvensjonell kjemoterapi kan øke behandlingseffekten. Vi vil i denne proof of principle-studien studere levermetastaser hvor ikke-eksponert metastase hos samme pasient vil fungere som intern kontroll. Når mikroboblene som injiseres i blodet ankommer svulsten som eksponeres for ultralyd begynner de å vibrere og vil etter hvert sprekke, som beskrevet i artikkelen av Snipstad i OnkoNytt Nr 2 fra 2017. Teorien er at mekaniske effekter av disse hendelsene vil øke opptaket av kjemoterapi lokalt.
Hvem skal inkluderes?
Pasienter med levermetastaser fra brystkreft og kolorektalkreft rekrutteres fra Kreftklinikken ved St. Olavs hospital. Pasientene skal være aktuelle for 1. linje behandling med hhv taksaner eller kombinasjonsregimet FOLFIRI.
Hvordan skal dette gjennomføres?
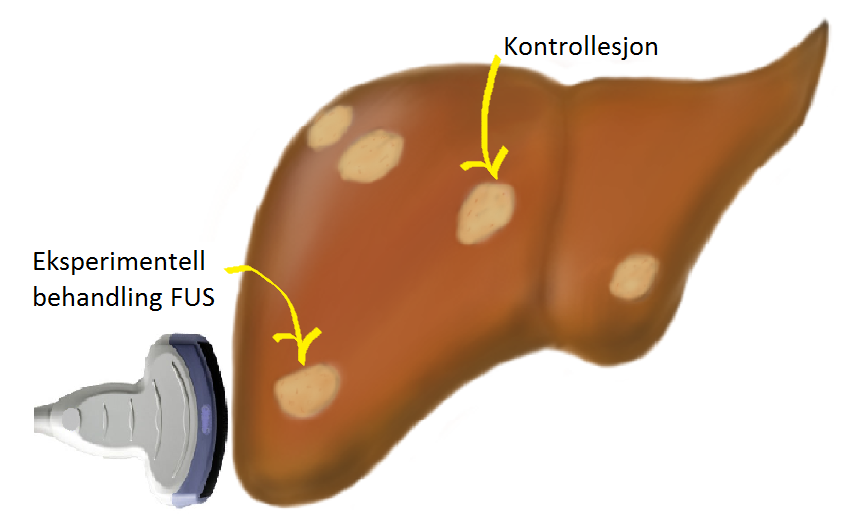
Pasientene gjennomgår vanlig undersøkelse med CT abdomen som utgangspunkt før oppstart kjemoterapi. På disse bildene vil man etter forhåndsvalgte kriterier velge to lesjoner som begge ligger til rette for behandling med fokusert ultralyd. Disse lesjonene vil bli randomisert til enten å være «mållesjon» som skal motta fokusert ultralyd, eller «kontrollesjon».
På behandlingsdagen skal pasienten først motta kjemoterapi etter nasjonale retningslinjer. Deretter skal de motta den eksperimentelle behandlingen. Ultralydproben fikseres over den aktuelle lesjonen som er randomisert til eksperimentell behandling. Pasienten skal så få injisert mikrobobler i form av Sonovue, som er et vanlig brukt kontrastmiddel ved ultralydavbildning. Injeksjonene skal gjentas 9 ganger i løpet av ca 30 minutter. Kolorektalkreftpasientene vil få tilkoblet 5-FU på infusor etter at den eksperimentelle behandlingen med fokusert ultralyd er avsluttet.
Hos brystkreftpasientene skal denne behandlingen gjentas hver 3. uke, både for pasienter som behandles med ukedose Taxol og for pasientene som mottar Taxotere hver 3. uke. For pasientene med kolorektalkreft vil behandlingen bli gitt i forbindelse med hver kur i perioden før responsevaluering, altså hver 2. uke. Ved responsevaluering med CT skal respons i mållesjon sammenlignes med respons i en kontrollesjon. Studiens primære endepunkt er forskjell i respons mellom metastasene som har mottatt eksperimentell tilleggsbehandling med fokusert ultralyd og mikrobobler og metastasene som kun er behandlet konvensjonell kjemoterapi og mikrobobler.
Teknologi og innovasjon
For å kunne tilby målrettet bildeveiledet behandling med fokusert ultralyd er man avhengig av tilfredsstillende bildekvalitet og oversikt over området som skal behandles. Samtidig må energien som avgis fra ultralydscanneren være optimalisert for å oppnå de biologiske effektene vi ønsker for å bedre tumors opptak av kjemoterapi. Denne studien er også et ledd i utviklingen av en bifrekvent 3-D ultralydprobe til bruk for kombinert diagnostikk og behandling. I samarbeid med Surf Technology og Institutt for sirkulasjon og bildediagnostikk (ISB) ved NTNU utvikles en bifrekvent probe som vi planlegger å ta i bruk i framtidige studier.
Figur 3: ACT Mekanismer.
Ved lokal ultralyd eksponering av svulsten vil ACT komponenten generere en større boble som midlertidig deponerer i patologisk mikrovaskulatur. Ytterligere ultralyd gjør at ACT boblen oscillerer, strekker på blodåreveggen og gjør denne mer permeable for legemiddel. Dette fører til lokalt øket opptak, forbedret distribusjon av virkestoff og en betydelig økning i terapeutisk effekt (illustrasjon: Phoenix Solutions AS / RIM DESIGN)
Hva kan resultatene brukes til?
En vellykket metode for økt lokal terapirespons vil kunne ha en rekke kliniske anvendelser både innen palliativ og kurativ virksomhet. Økt lokal effekt kan tenkes å føre til at man kan tilby lavere doser systemisk behandling og mindre bivirkninger. For lokalavanserte, inoperable tumorer vil økt lokal effekt også kunne være et viktig framskritt som ledd i neoadjuvant behandling.
Studien er godkjent av REK midt 2018/30 og er registrert på ClinicalTrials.gov/NCT03477019
Nye studier i Bergen
I tillegg til studien på levermetastaser i Trondheim, planlegges en oppfølgingsstudie/utvidelse av pankreasstudien2 i Bergen. Samme basale konsept for ultralydmediert, målrettet legemiddelbehandling vil benyttes; økt kjemoterapeutisk opptak i svulsten ved hjelp av samtidig administrering av cellegift, mikroboblekontrastmiddel (SonoVue) og lokal ultralyd insonering. Denne økning i opptak tilskrives rent biomekaniske effekter som oppstår når mikroboblene oscillerer i lydfeltet og dannelsen av transiente porøsiteter i cellemembranen.
Basert på forskningsgruppens tidligere positive erfaringer fra den første humane studien, har vi nå som mål å optimalisere prosedyren preklinisk og deretter overføre dette til dagens førstelinjes behandling av pasienter med bukspyttkjertelkreft. Vi har og tidligere vist at metoden er sikker og trolig gir forbedret terapeutisk effekt sammenlignet med cellegift alene. Vi mener denne type behandling vil gi en forlenget overlevelse og planlegger en større fase I/II studie for å bekrefte dette.
Studiene i Trondheim og Bergen vil begge benytte seg av regulære mikrobobleprodukter, i utgangspunktet utviklet som kontrastmidler for ultralyddiagnostikk. Som en forbedring av konseptet arbeider Phoenix Solutions AS (et norsk bioteknologiselskap) med utvikling av et nytt produkt hvor boblenes egenskaper er optimalisert for terapeutisk bruk; Acoustic Cluster Therapy (ACT). Virkningsmekanismene er som ved bruk av regulære ultralyd kontrastmidler, men ACT boblenes størrelse gjør at virkningsgraden blir vesentlig forbedret (cf. Figur 3). ACT representerer en unik plattform for målrettet levering av legemidler og har gjennomgått en lang rekke prekliniske studier med svært lovende resultater,,. I samarbeid med Institute of Cancer Research/Royal Marsden Hospital (UK), Oslo og Haukeland Universitetssykehus planlegges oppstart av kliniske studier med ACT kombinert med konvensjonell kjemoterapi for behandling av levermetastaser fra kjent adenocarcinom i januar 2019.
Avsnittet som omhandler studien i Bergen er skrevet av professor Georg Dimcevski ved NSGU, Haukeland Universitetssyskehus /Klinisk institutt 1, UiB.
Referanser:
Snipstad D, Berg S, Mørch Y, Bjørkøy A, Sulheim E, Hansen R, Grimstad I, van Wamel A, Maaland AF, Torp SH, Davies CL. Ultrasound improves the delivery and therapeutic effect of nanoparticle-stabilizes microbubbles in breast cancer xenografts. Ultrasound Med Biol. 2017 Nov;43(11):2651-2669.
Dimcevski G, Kokopoulis S, Bjånes T, Hoem D, Schjøtt J, Gjertsen BT, Postema M, Gilja OH. A human clinical trial using ultrasound and microbubbles to enhance gemcitabine treatment of inoperable pancreatic cancer. Journal of Controlled Release 243 (2016) 172–181.
A. vvan Wamel et al. Acoustic Cluster Therapy (ACT) – pre-clinical proof of principle for local drug delivery and enhanced uptake, J Control Release, 224 (2016) 158-164.
S. Kotopoulis et al., Acoustic Cluster Therapy (ACT®) induces transient tumour volume reduction in a subcutaneous xenograft model of pancreatic ductal adenocarcinoma. J Control Release, 245 (2016) 70-80.
Bush N. et al., Acoustic Cluster Therapy (ACT) enhances the therapeutic efficacy of Doxil™ for treatment of triple negative human breast cancer in mice, poster at “Acoustic bubbles in therapy: recent advances with medical microbubbles, clouds and harmonic antibubbles”, Le Studium Conference, October 2017, Tours, France.