Klinikk
Strålebehandling ved malignt melanom
K. Dolven Jacobsen. Overlege, Avdeling for kreftbehandling, Oslo Universitetssykehus
Medikamentell behandling med immunterapi og BRAF-/MEK hemmere har de senere år revolusjonert behandlingen av metastaserende melanom. Strålebehandling er allikevel fortsatt aktuelt for mange pasienter og kan gi god palliasjon og langvarig lokal kontroll av både inoperabel lokoregional sykdom og fjernmetastaser. Dette spesielt hvis tumor ikke er for stor. Det kan imidlertid være stor variasjon i strålefølsomhet fra tumor til tumor, også hos samme person.
Strålebehandling av -primærtumor
De fleste Kutane melanomer diagnostiseres i et tidlig stadium mens radikal kirurgisk eksisjon er mulig. Strålebehandling av primære melanomer i hud er sjelden aktuelt. Et unntak er store lentigo maligna melanom i ansiktet. Dette er spesielt aktuelt hos eldre og der rekonstruktiv kirurgi vil være vanskelig. Strålebehandling er også aktuelt post-operativt der det ikke foreligger frie reseksjonsflater og det ikke er aktuelt med ytterligere kirurgi. Ved Oslo Universitetssykehus Radiumhospitalet brukes 50 kV røntgenterapi med dosering 4 Gy x 12 ved lentigo maligna melanom som er mindre enn 4 cm og 3 Gy x 17 eller eventuelt 2,5 Gy x 20 ved større lesjoner. Behandlingen er vanligvis kurativ.
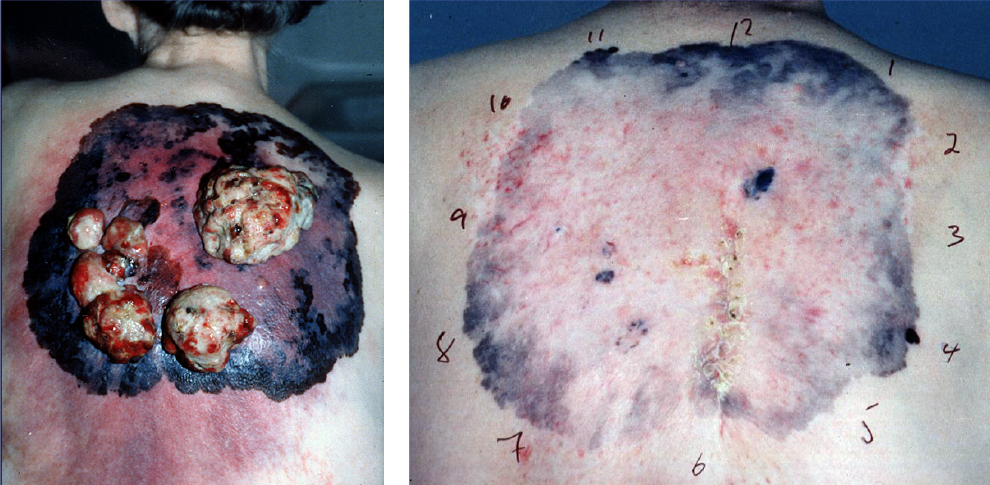
Ved inoperabelt lokalavansert kutant melanom kan det også være aktuelt å strålebehandle primærtumor. Behandlingen er palliativ. Disse pasientene har ofte metastaser og har behov for systemisk behandling i tillegg. Ved mindre melanom i øyet kan spesialisert strålebehandling gi kurativ effekt og spart om enn noe nedsatt øyefunksjon. En stor andel av disse pasientene får dessverre levermetastaser. Ved lokalavansert melanom i slimhinner i hode-, halsregionen gis strålebehandling og / eller immunterapi. (Bilde 1)
Strålebehandling av -regionale lymfeknute-metastaser og in-transit metastaser (stadium III)
Det foreligger ikke sikker dokumentert effekt på recidivfri overlevelse eller total overlevelse av postoperativ strålebehandling etter radikal lymfeknutetoalett selv ved perinodal tumorvekst. En har derfor gått bort fra slik behandling som også kan medføre økt lymfødem og fibrose og vanskeliggjøre reoperasjon. Pasienter som er operert for stadium III eller IV sykdom kan nå som oftest få adjuvant behandling med immunterapi eller BRAF-/MEK hemmer.
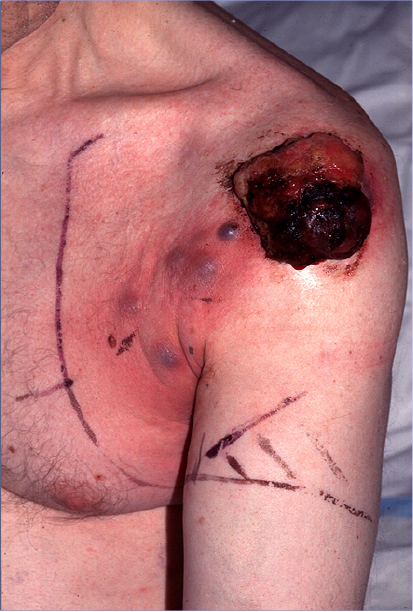
Strålebehandling bør vurderes ved inoperable regionale metastaser eller inoperabelt recidiv etter lymfeknutetoalett der eventuell immunterapi, BRAF-/ MEK hemmer eller ECT (Electrochemotherapy) ikke er aktuelt eller har ønsket effekt. Behandlingen er palliativ. Vanlig fraksjonering er 3 Gy x 10 eller 4 Gy x 5-6. (Bilde 2)
Ved cutane / subcutane –in-transit metastaser spesielt på underekstremiteter kan det være aktuelt å strålebehandle disse. Dette spesielt dersom kirurgi, systemisk behandling med immunterapi, BRAF-/MEK hemmer, ECT eller regional kjemoterapi (ILP – Isolated Limb Perfusion eller ILI – Isolated Limb Infusion) ikke er aktuelt eller har ønsket effekt.
Strålebehandling kan føre til en systemisk anti-tumor immunrespons som viser seg ved at metastaser utenfor det strålebehandlede målvolumet også blir mindre – en såkalt abscopal effekt. Gode data støtter en synergistisk effekt ved å kombinere strålebehandling og immunterapi med økte responsrater så vel innenfor som utenfor stråle-behandlet område ved melanom (Park SS et al). Dramatiske responser har vært rapportert og har også vært observert ved Radiumhospitalet (Mohiudin M et al). Det er viktig å utnytte denne muligheten for eksempel ved in-transit metastaser. Aktuelle fraksjoneringsregimer er gjerne 3 Gy x 10 eller 4 Gy x 5, avhengig av lokalisajon og sykdomsutbredelse.
Strålebehandling skal ikke gis samtidig med BRAF-/MEK hemmer på grunn av fare for betydelige bivirkninger, spesielt fra hud. Pasienten må derfor ta pause fra den medikamentelle behandlingen 1 uke før, under og 1 uke etter strålebehandling. Man trenger ikke å pause immunterapi.
Strålebehandling av -fjernmetastaser med «-kurativ» intensjon
Vanligste indikasjon for strålebehandling ved melanom er fjernmetastaser. Behandlingen er vanligvis palliativ og er i de fleste tilfellene ikke annerledes enn behandlingen som man gir ved metastaser fra andre cancertyper (det vises til de overordnede artiklene om hjernemetastaser (Onkonytt nr 1, 2019), levermetastaser (Onkonytt nr 1, 2019) og skjelettmetastaser (denne utgaven)). Stereotaktisk strålebehandling gis imidlertid stadig oftere med meget godt resultat og «kurativ» intensjon ved begrenset metastaseutbredelse (oligometastaser, 1-5) – oftest i hjerne, lunger og lever, men også i binyrer og columna.
Hjernemetastaser
Ved en eller få hjernemetastaser der kirurgi ikke er aktuelt bør stereotaktisk strålebehandling vurderes. Vanligvis gis en fraksjon a 18–25 Gy avhengig av tumors diameter. Ved spesielle lokalisasjoner eller bestråling av flere metastaser samtidig gis behandlingen ofte fraksjonert, for eksempel 9 Gy x 3. Det sees respons hos 85–90 % av pasientene. Etter 6 mnd er 86 % av bestrålte lesjoner funnet progresjonsfrie og tallet er 76 % etter 1 år (Noel et al). Rebestråling er mulig. Postoperativ stereotaktisk strålebehandling bør vurderes ved mistanke om resttumor i operasjonskaviteten etter kirurgi. Det pågår studier for om mulig å kunne avgjøre hvilke pasienter med hjernemetastaser fra melanom (eller cancer pulm) som vil ha effekt av stereotaktisk strålebehandling og hvordan man kan skille progresjon fra strålenekrose etter slik behandling (Digernes et al)
Å gi adjuvant strålebehandling mot hele hjernen etter lokal behandling av inntil 3 metastaser bedrer ikke overlevelsen (Hong et al). (Bilde 3)
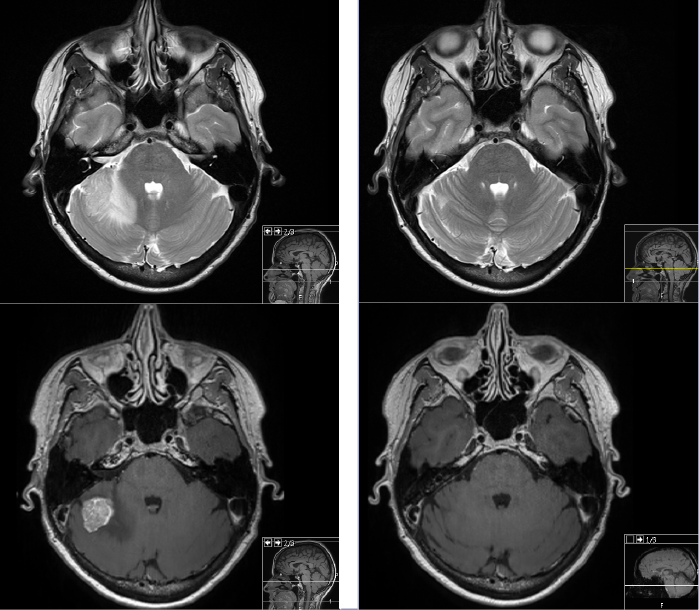
Bilde 3. Hjernemetastase før og 5 måneder etter stereotaktisk strålebehandling. (Avd for radiologi OUS)
Andre metastaser
Ved perifert beliggende lungemetastaser gis ofte 15 Gy x 3. Ved metastaser beliggende nær hilus / mediastinum er vanlig fraksjonering 7 Gy x 8. Ved metastaser i for eksempel lever, milt og binyrer er vanlig fraksjonering 10–15 Gy x 3, avhengig av størrelse og beliggenhet.
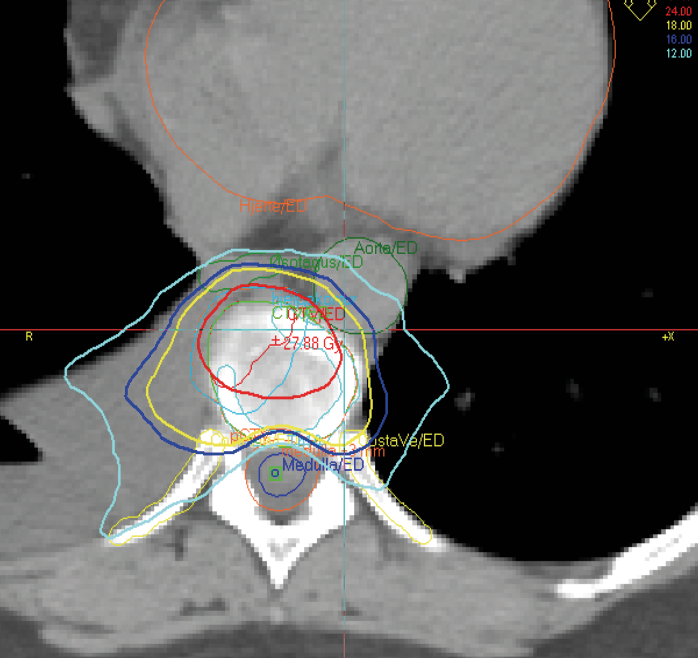
Stereotaktisk strålebehandling kan også gis med godt resultat ved en eller få metastaser i columna dersom disse ikke er lokalisert helt inntil spinalkanalen. Vanligvis gis da en fraksjon a 16 Gy. Slik behandling øker sannsynligheten for tumorkontroll, rask klinisk respons og en mer langvarig effekt. Rebestråling er ofte mulig på grunn av redusert dosebidrag til medulla spinalis. (Bilde 4)
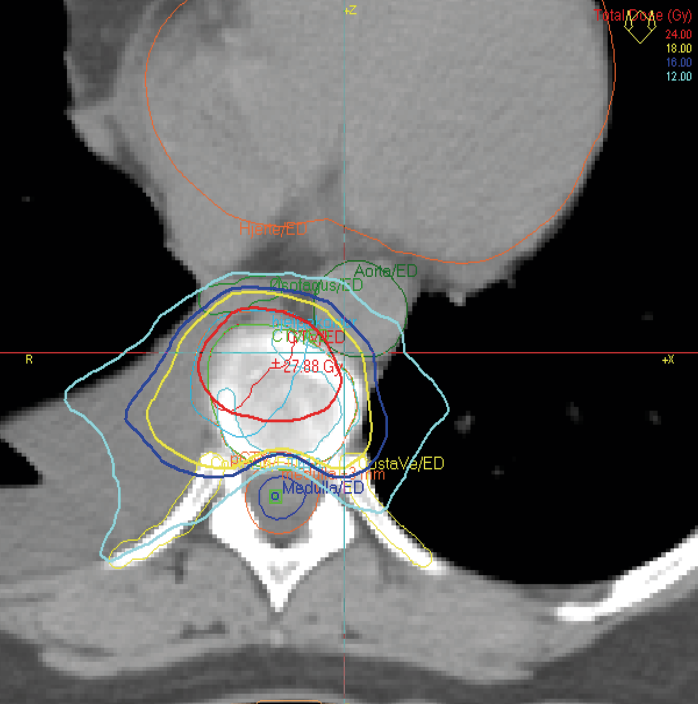
Bilde 4. Stereotaktisk strålebehandling mot metastase i columna 16 Gy x 1 (liten stråledose mot medulla)
Referanser
Park SS, Dong H, Liu X, Harringtonet SM, Krcoc J, Grams MP et al. PD-1 Restrains Radiotherapy-Induced Abscopal Effect. Cancer Immunol Res 2015; 3: 610.
Mohiudin M, Park H, Hallmeyer S, Richards J. High-Dose Radiation as a Dramatic, Immunological Primer in Locally Advanced Melanoma. Cureus 2015; 7: e417.
Noel G, Simon JM, Valery CA, Comu P, Boisserie G, Ledu D et al. Linac radiosurgery for brain metastasis of melanom. Stereotact Funct Neurosurg 2002; 79: 245-255.
Digernes I, Grøvik E, Nilsen LB, Saxhaug C, Geier O, Reitan E et al. Brain metastases with poor vascular function are susceptible to pseudoprogression after stereotactic radiation surgery.Advances in radiation Oncology 2018,3 (4): 559-567.
Hong AM, Fogarty GB, Dolven Jacobsen K , Burmeister BH, Lo SN, Haydu LE et al. Adjuvant Whole-Brain Radiation Therapy Compared With Observation After Local Treatment of Melanoma Brain Metastases: A Multicenter, Randomized Phase III Trial. J. Clin. Oncol, 2019 Sep 25. JCO 1901414.