Hovedartikler
Palliativ strålebehandling av blærekreft
Blærekreft er den fjerde største kreftformen blant norske menn med 1350 tilfeller per år som utgjør cirka 7 % av alle krefttilfeller. Forekomsten er lavere hos kvinner, men likevel er det cirka 450 kvinner årlig som får blærecancer. Omlag 90% er av typen urotelialt carcinom, og røyking er hovedårsaken bak denne kreftformen.
RENÉ VAN HELVOIRT, Onkolog, Senter for kreftbehandling (SFK), Sørlandet sykehus Kristiansand
MULTIDISCIPLINÆR TEAM (MDT) VURDERING
Pasienter med muskelinfiltrerende blærekreft som er teknisk og/eller medisinsk inoperabel, må bli diskutert på MDT med tanke på muligheten for å gi kurativ rettet onkologisk behandling, fortrinnsvis i form av trippelbehandling med TURB etterfølgt av kjemoradioterapi, eller alternativt, enten TURB etterfølgt av radioterapi eller primær (kjemo) radioterapi. Ved optimal behandling vil overlevelsen være på høyde med det man kan oppnå med cystectomi, dvs. 5-års overlevelse på 45-50%. Ved radikal strålebehandling alene er 5-års overlevelsen 25-30%. Høydosert kjemoradioterapi eller radioterapi bør også vurderes for pasienter med lokalvansert (T3-T4) ikke metastatisk sykdom med mål om å oppnå langvarig lokalkontroll. Omkring 10-15% av blærekreft pasientene har derimot regional- og/ eller fjernmetastatisk sykdom ved diagnosetidspunkt uten mulighet for kurasjon. Og så finnes det pasienter med ikke metastatisk blærekreft som har en slik alvorlig komorbiditet at de har kort forventet levetid. I slike situasjoner kan palliativ strålebehandling være et godt og effektivt alternativ.
PROGNOSE OG CANCER RELATERT MORBIDITET
Median overlevelse for pasienter med blærekreft i en palliativ setting er rundt 7-9 måneder og i underkant av 25% er i live etter 1 år. De 2 viktigste prognostiske faktorene er tumorstadium og ECOG Performance Status (PS). Pasienter med ECOG 3-4 har median overlevelse under 4 måneder. Mange pasienter utvikler betydelig cancer relatert morbiditet i denne fasen av sykdommen. Plagene kan plasseres i 3 kategorier: hematuri, smerter og nedre urinveissymptomer (lower urinary tract symptoms, LUTS).
Signifikant hematuri oppstår hos over en tredjedel av pasientene. Ved siden av den psykiske belastningen som dette gir, vil mange også oppleve blæreretensjon og smerter fordi det danner seg koagler som obstruerer avløpet. Kateterisering er i så fall nødvendig og ikke sjeldent må pasienten tilbringe en del dager på sykehuset med blæreskyllkateter.
– Smerteproblematikk kan stå for seg selv i form av kontinuerlige bekkensmerter (for eksempel ved innvekst av primærtumoren i omgivende vev), men er oftere relatert til selve vannlatingen i form av dysuri.
– Lokal tumorvekst kan medføre både tømmingsproblemer og lagringsproblemer som samles under begrepet LUTS (svak stråle, etterdrypp, ufullstendig tømning, pollakisuri, nocturi).
PALLIATIV STRÅLEBEHANDLING FRA ET HISTORISK PERSPEKTIV
Palliativ strålebehandling av blærekreft har blitt en del av repertoaret gjennom ‘å prøve seg fram’. Man observerte gode effekter av strålebehandling, spesielt på hematuri, men også på smerter og LUTS, og kunnskap ble formidlet videre fra mester til svenn. Dette gjenspeiles i at det stadig er mange forskjellige fraksjoneringsregimer i bruk omkring i verden, f.eks. 3Gy*10-13, 3.5Gy*10, 4Gy*5, 5-6Gy*6, 7Gy*3 og 8Gy*1-3. I senere tid har enkelte av disse regimene blitt evaluert på en mer grundig måte og til og med i en randomisert studie. Disse beskrives mer i detalj nedenfor.
RADIOBIOLOGISKE BETRAKTNINGER
I noen av de ovennevnte regimene (5-6Gy*6, 8Gy*3) gis bare 1 strålefraksjon per uke. Dette er selvfølgelig gunstig med tanke på strålebelastningen til de gjenværende friske blærecellene og det friske vevet omkring blæren (bl.a. rectum) og man forventer og ser ved slike regimer mindre behandlingsrelatert toksisitet. Man kunne frykte tumorcelle-repopulasjon, men studier viser at repopulasjon ikke skjer i nevneverdig grad ved urotelial kreft i de første 5-6 behandlingsukene. I praksis vil det si at den totale behandlingstiden (overall treatment time) ikke har så mye og si for resultatet av strålebehandling ved blærekreft.
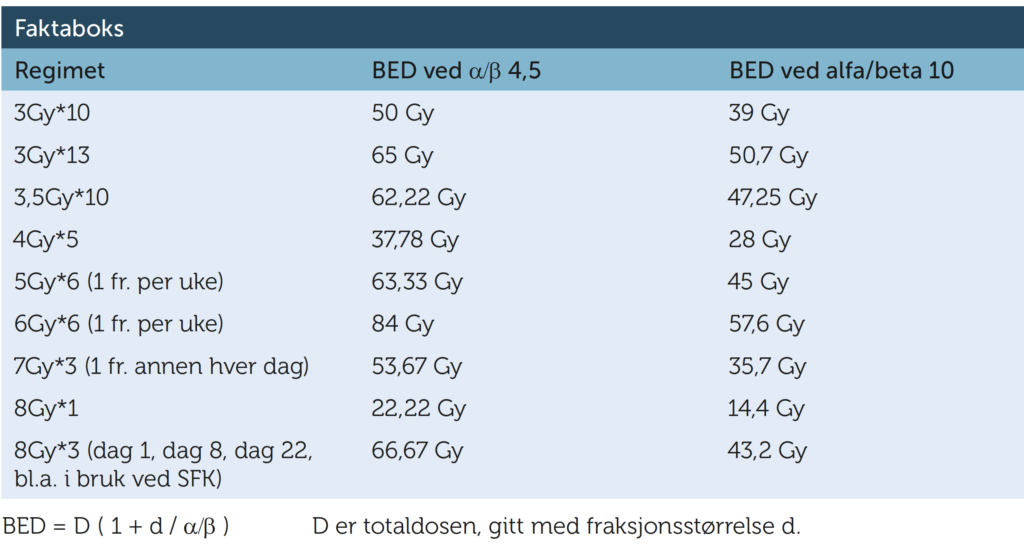
In vitro studier har antydet at uroteliale kreftceller kan ha et reaksjonsmønster på strålebehandling som ligner den vi ser i sent reagerende friskt vev, det vil si at de i så fall har en forholdsvis lav alfa/beta ratio (~4,5) (α/β- ratioen beskriver sensitiviteten for strålefraksjonering i vevet som er under vurdering). Dette kan være forklaringen på den gode effekten som er beskrevet ved bruk av mer hypofraksjonert strålebehandling. Men beregninger basert på pasientbehandlinger har også vist høyere α/β ratioer og derfor er det vanskelig å konkludere på hva som er sikker dose-respons innenfor de ulike regimene. For å få et inntrykk av hvor de forskjellige behandlingsregimene dosemessig sett befinner seg i forhold til hverandre, viser faktaboksen den biologiske effektive dosen (biologically effective dose, BED), både for α/β ratio på 4,5 og for α/β ratio på 10. Basisen for beregningene er den lineær-kvadratiske celle-overlevelsesmodellen. BED er den teoretiske dosen, gitt i uendelig små fraksjonsstørrelser, som gir samme biologiske endepunkt (for eksempel tumor kontroll) som det anvendte dose-fraksjoneringsregimet.
MÅLVOLUMSDEFINISJON
Selv om tumoren kan være begrenset til en del av blæren, vil man i de aller fleste tilfellene betrakte hele blæren som målvolum (inkludert eventuell ekstramural tumorutbredelse). Eksakt tumorutbredelse i selve blæreveggen er ofte vanskelig å avgrense og dessuten er disse svulstene ofte multifokale. En eventuell partiell blærebestråling vil også behandlingsmessig være mer utfordrende på grunn av posisjoneringsusikkerhet. Behandlingene gis fortrinnsvis med tom blære, både for å få en mest mulig stabil og reproduserbar behandlingssituasjon, og for å begrense det totale behandlingsvolumet. Hvis pasienten har tømningsproblemer med resturin (noe som kan forverre seg i løpet av en behandlingsserie på grunn av stråleindusert ødem), bør man vurdere å legge inn et kateter i behandlingsperioden eller engangskateterisere pasienten like før hver strålefraksjon. Alternativt kan det tas cone-beam CT imaging i forbindelse med hver fraksjon og tilpasning av strålefeltet. Clinical target volume (CTV) vil være blærens ytre veggbegrensning (men obs eventuell ekstramural tumorutbredelse) og planning target volume (PTV) vil ha en margin på 1-2 cm omkring CTV.
EFFEKT AV STRÅLEBEHANDLING PÅ HEMATURI
Strålebehandling har vist seg å være effektivt mot blødninger i flere tumortyper og effekten kommer ofte raskt. Den initiale effekten tilskrives stimulering av blodplatene med økt adherens til endotelet. På lang sikt tror man at forklaringen ligger i kombinasjonen av fibrose i mikrovaskulaturen og partiell tumorregresjon.
I Medical Research Council (MRC) BA09 studien ble 500 pasienter randomisert til enten 3,5Gy*10 eller 7Gy*3 (Duchesne, 2000, ref 1). Det var 167 pasienter som hadde signifikant hematuri ved behandlingsstart og 50% av disse var fri for hematuri like etter siste fraksjon. Hos en del pasienter kom effekten noe forsinket og ved evaluering etter 3 måneder var hele 88% fri for hematuri. Det var ingen forskjell mellom de 2 fraksjoneringsregimene. Blødningsresidiver ble sett, men median tid til tilbakefall av blødninger var 9 måneder, og det vil si at majoriteten av pasientene ikke opplevde nye blødninger i deres gjenværende levetid som var median 9 måneder.
I en belgisk prospektiv studie fikk 44 pasienter strålebehandling med fraksjonering 5,75Gy*6 gitt med 1 fraksjon per uke (Dirix, 2016, ref 2). Hele 38 pasienter (86%) hadde hematuri ved behandlingsstart og 34 av disse (89%) ble fri for hematuri etter behandlingen. Bare 2 pasienter fikk tilbakefall av blødninger i deres gjenværende levetid. Den mediane overlevelsen i kohorten var 10,5 måneder.
En retrospektiv studie analyserte effekten av regimet 5-6Gy*6 gitt med 1 fraksjon per uke hos 65 gamle pasienter (median alder 78) (McLaren, 1997, ref 3). Det var 37 pasienter med hematuri og 34 av disse (92%) var fri for nevneverdig hematuri ved 3 måneders evalueringen. Median symptomfri overlevelse var 7 måneder og median overlevelse var 9 måneder.
En stor retrospektiv studie fra England med 241 pasienter som fikk behandling med mange forskjellige fraksjoneringsregimer (fra så lavt som 8Gy*1 til så høyt som 6Gy*6) rapporterte om 54% suksess når det gjaldt hematuri (Ali, 2019, ref 4). Median overlevelsen ble beregnet fra dagen at pasientene fikk sin siste strålefraksjon og var på bare 5 måneder. Hele 25% av pasientene fullførte ikke den planlagte stråleserien og/eller døde innen 30 dager etter behandlingen.
I en interessant kohortstudie fra Singapore ble 58 pasienter med hematuri evaluert med tanke på relasjonen mellom dose (i BED, beregnet med α/β ratio 10) og effekt på hematurien (Tey, 2019, ref 5). Forskjellige regimer ble brukt og median BED var 36Gy. Det var 39 pasienter (67%) som hadde god effekt av strålebehandling og det var ingen signifikant forskjell i respons sannsynlighet mellom de 36 pasientene som hadde fått et regime med BED < 36Gy og de 22 pasientene som hadde fått et regime med BED > 36Gy. En tredjedel av pasientene som hadde respondert fikk nye signifikante blødninger etter hvert og her var det en tydelig forskjell når det gjaldt den initiale stråledosen: pasientene som hadde fått et lavt BED regime hadde en over 5 ganger høyere risiko for nye blødninger sammenlignet med de som hadde fått et høyt BED regime (hazard ratio 5,76). Median tid til tilbakefall av blødninger var 3,7 måneder. Median overlevelsen ble beregnet fra dagen at pasientene fikk sin siste strålefraksjon og var på bare 5,6 måneder. BED var ikke signifikant assosiert med overlevelsen.
EFFEKT AV STRÅLEBEHANDLING PÅ SMERTER OG LUTS
Effekten på smerter og LUTS kan egentlig ikke evalueres for det har gått en god del uker etter strålebehandlingen. både fordi selve behandlingen kan forverre disse plagene midlertidig på grunn av strålebetinget blæreirritasjon (se avsnitt nedenfor) og fordi symptomlindrende regress av tumorforandringene tar tid.
I den ovennevnte MRC studien hadde 44% av pasientene dysuri, 36% nocturi og 16% pollakisuri ved baseline (1). Etter 3 måneder opplevde de aller fleste pasientene en god behandlingseffekt: 88% rapporterte bedring i sin dysuri, 62% i sin nocturi og 72% i sin pollakisuri. Men ved det første evalueringstidspunktet som var 1-2 uker etter strålebehandlingen var det symptomforverring hos en tredjedel av pasientene, noe som kunne forventes siden det oppstår bivirkninger av behandlingen hos mange. Varigheten av perioden at pasientene opplevde symptomforbedring var median 9 måneder. Det var ingen forskjell mellom de 2 fraksjoneringsregimene.
I studien hvor det ble gitt 5-6Gy*6 var det 51% som rapporterte om bedring i LUTS (3). Varigheten av symptomlindringen var 7 måneder. Forskjellige andre retrospektive studier hvor samme regimet ble brukt viser tilsvarende tall.
I den store retrospektive studien fra England ble det beskrevet 56% bedring i LUTS og 47% bedring i smertescore (4).
KONSEKVENSER AV FORTSATT RØYKING
Som en av få, har studien fra Singapore registrert røykestatus og sett på hvilken konsekvens dette har for effekten av strålebehandlingen på hematuri (5). Ved siden av BED (se ovenfor) var røyking signifikant assosiert med residiv av hematuri med en hazard ratio på 4,36. Det var ingen forskjell mellom eks-røykere og aldri røykere. Forskjellen når det gjaldt den initiale hemostatiske responsen på behandlingen var ikke signifikant.
BEHANDLINGSRELATERTE AKUTTE BIVIRKNINGER
Strålebehandling vil irritere både selve blæren og det omkringliggende vevet bl.a. rektum. Som allerede nevnt ovenfor var det i MRC studien en initial forverring av LUTS hos 33% av pasientene (1). Økt avføringsfrekvens og diare ble sett hos henholdsvis 36% og 40% av pasientene og rektale smerter hos 20%.
I studien hvor det ble gitt 5-6Gy*6 ble grad 3 urinveistoksisitet notert hos 18% og grad 3 tarmtoksisitet hos 12% (3).
I den belgiske prospektive studien (5,75Gy*6) var det bare 9% av pasientene som opplevde grad 3 urinveistoksisitet og det var ingen høygradig tarmtoksisitet (2). Milde urinveisbivirkninger (grad 1-2) ble sett hos 46% og milde intestinale bivirkninger hos bare 5%. Den mest frekvente urinveisbivirkning var urge (55%). Strålecystitt ble sett hos 24% og kontinensplager hos 18%.
BEHANDLINGSRELATERT SENSKADE
Fordi uhelbredelig blærekreft har en så dårlig prognose, er behandlingsrelatert senskadeproblematikk som regel neglisjerbart. Men for de som overlever 1 år eller mer, ser det ut som om at risikoen for mer alvorlig senskade (grad 3 eller høyere) er liten ved bruk av disse palliative regimene (under 10%). Lavgradig sen urinveistoksisitet (oftest i form av urge og høy frekvens) er beskrevet hos opptil 25-30% av pasientene. Uansett er disse tallene vanskelig å tolke ettersom gjenværende tumor eller residiv tumorvekst i mange tilfeller vil være en medvirkende årsak til symptomene.
KONKLUSJON OG ANBEFALINGER
Palliativ strålebehandling er en effektiv behandlingsmodalitet for pasienter med symptomgivendeuhelbredelig blærekreft, både for de med hematuri, LUTS og/eller smerter. Siden prognosen for de aller fleste av disse pasientene er dårlig med en median overlevelse på 7-9 måneder, skal det velges stråleregimer som er minst mulig belastende, både logistisk sett (så vel for pasienten som for avdelingen) og med tanke på bivirkningsprofilen. Hvis pasienten har en forventet levetid som ikke overstiger 3 måneder, vil en engangsfraksjon på 8Gy ha nok palliativ effekt for de fleste. Har pasienten lengre forventet levetid, bør man velge et regime med høyere BED med mål om mer langvarig effekt. I sistnevnte gruppe er røykeslutt viktig. Regimene med 1 fraksjon per uke ser ut til å komme gunstig ut når det gjelder behandlingsrelaterte bivirkninger.
Er man i tvil om hvor pasienten prognostisk sett befinner seg, eller om pasienten vil tåle behandlingen, kan man med fordel velge et regime med 1 fraksjon per uke (hvis reiseavstanden og belastningen tillater det), slik at pasienten kan bli revurdert underveis og behandlingen eventuelt stoppet hvis pasienten fallerer.
A. Stråleregime ved prognose under 3 måneder:
8Gy * 1 (kan alltid gjentas ved behov)
B. Stråleregimer ved prognose som sannsynligvis er lengre enn 3 måneder (tvilsituasjon):
7 Gy * 3 (1 fraksjon annenhver dag); kan da eventuelt gjøres som inneliggende pasient i 1 uke
5-6Gy * 6 (1 fraksjon per uke); vurder ukentlig og stopp hvis pasienten fallerer
8Gy * 3 (dag 1, dag 8, dag 22); også her, vurder underveis og stopp ved behov
C. Stråleregimer ved bedre prognose (over 4 måneder):
3,5Gy * 10 (5 fraksjoner per uke)
7Gy * 3 (1 fraksjon annenhver dag)
6Gy * 6 (1 fraksjon per uke)
Referanser
1. G M Duchesne, J J Bolger, G O Griffiths, J Trevor Roberts, J D Graham, P J Hoskin, S D Fossâ, B M Uscinska, M K Parmar. A randomized trial of hypofractionated schedules of palliative radiotherapy in the management of bladder carcinoma: results of medical research council trial BA09. Int J Radiat Oncol Biol Phys. 2000 May 1;47(2):379-88.
2. Piet Dirix, Sofie Vingerhoedt, Steven Joniau, Ben Van Cleynenbreugel, Karin Haustermans. Hypofractionated palliative radiotherapy for bladder cancer. Support Care Cancer (2016) 24:181–186.
3. McLaren DB, Morrey D, Mason MD. Hypofractionated radiotherapy for muscle invasive bladder cancer in the elderly. Radiother Oncol. 1997 May;43(2):171-4.
4. Amin Ali, Yee Pei Song, Shaveta Mehta, Hitesh Mistry, Ruth Conroy, Catherine Coyle, John Logue, Anna Tran, James Wylie, Tanzeel Janjua, Lisa Joseph, Joji Joseph, Ananya Choudhury. Palliative Radiation Therapy in Bladder CancerdImportance of Patient Selection:A Retrospective Multicenter Study. Int J Radiation Oncol Biol Phys, Vol. 105, No. 2, pp. 389e393, 2019.
5. Jeremy Tey, Yu Yang Soon, Timothy Cheo, Kiat Huat Ooi, Francis Ho, Balamurugan Vellayappan, David Chia, Bee Choo Tai. Efficacy of Palliative Bladder Radiotherapy for Hematuria in Advanced Bladder Cancer Using Contemporary Radiotherapy Techniques. In Vivo. Nov-Dec 2019;33(6):2161-2167.
6. Sophie E. M. Raby, Peter Hoskin, Ananya Choudhury. The role of palliative radiotherapy in bladder cancer: a narrative review. Ann Palliat Med 2020;9(6):4294-4299.
7. Barbara A. Jereczek-Fossa, Giulia Marvaso. Palliative radiation therapy in bladder cancer: a matter of dose, techniques and patients’ selection. Ann Palliat Med 2019;8(5):786-789.
8. Jing Yan, M. Milosevic, A. Fyles, L. Manchul, V. Kelly, W. Levin. A Hypofractionated Radiotherapy Regimen (0-7-21) for Advanced Gynaecological Cancer Patients. Clinical Oncology 23 (2011) 476e481.
9. Kang jj, Iwamoto KS, Peek EM, et al. The Lown Alpha-Beta Ratio of Bladder Cancer: A Rationale for Hypofractionation. Proceedings of the 96th Annual Meeting of the American Radium Society 2014. https://www.cancernetwork.com/ars-2014/s036-low-alpha-beta-ratio-bladder-cancer-rationale hypofractionation.
