Klinikk
Nyrecellekreft anno 2015 – en oppdatering på medikamentell behandling
Christoph Müller1 Anne Helene Køstner1, Frede Donskov2

Frede Donskov

Christoph Müller

Anne Helene Køstner
1Senter for kreftbehandling, Sørlandet Sykehus Kristiansand
2Onkologisk afdeling, Aarhus Universitetshospital, Danmark
Innledning
Effektiv medikamentell behandling av nyrecellekreft er ikke eldre enn ti år. Åtte medikamenter bidrar i dag til forlenget overlevelse av pasienter med metastatisk nyrecellekreft. I løpet av de siste årene har man oppnådd en konsolidering av den nye behandlingsalgoritmen. Onkologen har nå en rolle utover ren symptomlindring og er blitt en viktig partner i det multidisiplinære behandlingsteamet. Vi ønsker å gi en oversikt over medikamentell nyrekreftbehandling med sentrale referanser for videre studium.
Forekomst og histologi
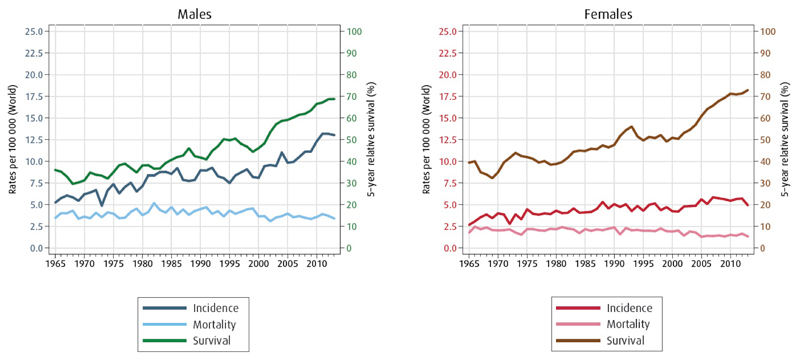
Her omtales primær nyrecellekreft som utgjør ca. 90 % av alle cancere i nyren. I Norge ble det i 2013 diagnostisert 746 nye krefttilfeller og ca. 16 % var metastatisk på diagnosetidspunktet[1]. I 2013 døde 265 pasienter av nyrekreft. I mange land inkl. Norge observeres at insidensen stiger mens mortalitetsraten er vesentlig stabil, og overlevelsen er derfor økende (figur 1). Tidligere diagnostikk samt bedre kirurgisk og medikamentell behandling bidrar vesentlig til forbedret prognose, mens
5 års overlevelsen ved metastatisk sykdom fortsatt er lav med ca. 10 %. Kreftformen rammer flere menn enn kvinner i et forhold på 1,5:1 [1].
Nyrecellekarsinomer er en histologisk heterogen gruppe svulster. Majoriteten er «klassiske» klarcellete karsinomer, men 15 – 25 % har ikke-klarcellet histologi, herunder papillære og kromofobe karsinomer. Sarkomatoid transformasjon kan oppstå i alle histologiske subtyper og finnes i 5- 10 % av alle nyrecellekarsinomer[2].

Figur 1: Nyrekreft: insidens og mortalitetsrate per 100.000 innbyggere, relativ 5 års overlevelse (Cancer in Norway 2013).
Multidisiplinære behandlingsaspekter
Neoadjuvant/adjuvant medikamentell behandling ved ikke metastatisk sykdom
Primær nefrektomi bør utføres dersom det er mulig og indisert. Neoadjuvant behandling med sunitinib eller pazopanib kan redusere tumorvolumet med opptil en tredel og i enkelttilfeller fasilitere nefrektomi[3-5]. I alt 6 fase III studier som undersøker adjuvant behandling etter nefrektomi er gjennomført eller underveis. Tidlige data fra ASSURE studien (adjuvant sunitinib eller sorafenib eller placebo) ble presentert på GU-ASCO februar 2015 [35], men er enda ikke publisert. En meget stor andel av pasientene gjennomførte ikke den planlagte behandlingen pga. toksisitet. ASSURE viste ingen reduksjon i sykdomsrelatert overlevelse. Flere studier vil rapportere de kommende år. I dag vurderes adjuvant behandling som eksperimentell og anbefales ikke.
Nefrektomi ved metastatisk sykdom
Cytoreduktiv nefrektomi (CN) har gitt en liten overlevelsesgevinst i kombinasjon med interferonbehandling og denne strategien er blitt videreført etter introduksjon av de nye antivaskulære medikamentene. To randomiserte studier (CARMENA[6], SURTIME[7]) undersøker om CN i kombinasjon med medikamentell behandling gir en overlevelsesgevinst, men data vil ikke foreligge før om flere år. En nylig retrospektiv studie viste forbedret overlevelse med CN hos selekterte pasienter.
Det var derimot ingen overlevelsesgevinst blant pasienter i dårlig allmenntilstand og/eller ≥ 4 IMDC risikofaktorer, og CN frarådes for denne gruppe pasienter[8]. EAU guidelines anbefaler CN hos ”appropriately selected patients” i påvente av prospektive studier[2]. Dersom man velger primær medikamentell behandling, bør CN vurderes på nytt ved god radiologisk respons.
Det anbefales å seponere sunitinib eller pazopanib en uke før nefrektomi, og for bevacizumab 6 uker før nefrektomi. Etter nefrektomi kan den medikamentelle behandlingen gjenopptas etter sårtilheling, ca. 4 uker etter inngrepet (ref. produkt-omtale i felleskatalogen).
Fokal metastasebehandling
Komplett reseksjon av en solitær metastase eller oligometastatisk sykdom kan gi en overlevelsesgevinst for selekterte pasienter, men dokumentasjonen for dette er begrenset. Hvorvidt reseksjon av enkelte metastaser med gjenværende tumor gir en overlevelsesgevinst er ukjent. Symptomlindrende effekt er beskrevet for reseksjon, strålebehandling inkl. stereotaksi og embolisering. Det er på nåværende tidspunkt ikke mulig å gi en anbefaling for fokal metastase behandling, en slik strategi må vurderes på individuelt grunnlag[9].
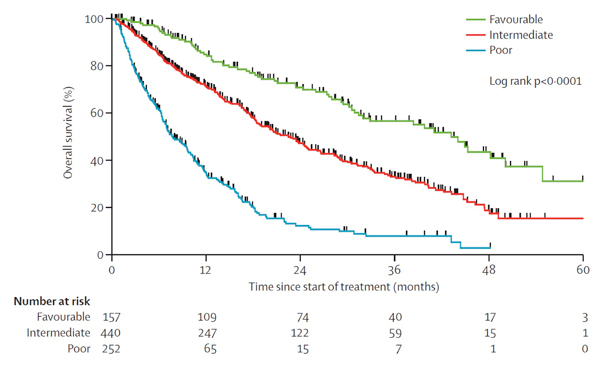
Figur 2: Overlevelse etter prognosegruppe, klarcellet nyrecellekarcinom, første linjes behandling 2004 – 2010, antivaskulær behandling (82% sunitinib, registerstudie Heng et al. Lancet Oncology 2013, gjengitt med tillatelse)[13]
Prognostiske verktøyer / Prediksjon av overlevelse ved metastatisk nyrecellekreft:
Mens stadium og histologisk malignitetsgrad definerer prognosen for ikke metastatisk klarcellet nyrecellekreft, er det kliniske faktorer som er avgjørende for prediksjon av overlevelse for metastatisk sykdom. De to mest brukte systemer er fra det internasjonale metastatisk-nyrecellekreft-database konsortium (IMDC, Heng[10]) og Memorial Sloan Kettering Cancer Center (MSKCC, Motzer[11]), selv om bare IMDC er utviklet på en pasientgruppe representativ for dagens behandling. Begge er tredelt; god prognose (ingen risikofaktorer), intermediær (1-2 risikofaktorer) og dårlig prognose (>= 3 risikofaktorer) (Tabell 1). Det er vesentlig å karakterisere pasientene i henhold til prognosegruppe for å treffe gode behandlingsvalg. Tabell 2 viser overlevelsesdata fra en randomisert fase III studie med pazopanib vs. sunitinib[12] og figur 1 viser validering av Heng kriteriene i IMDC registeret.
Pas. i god prognosegruppe har i dag en median forventet levetid på 3 – 4 år i motsetning til pasienter i dårlig prognosegruppe hvor den mediane overlevelsen er mindre enn et år. Likevel vil et fåtall av pasienter med dårlig prognose kunne oppleve gode og relativt langvarige behandlingsresponser[14].
Betydningen av IMDC risikogruppering er validert for klarcellet RCC [13] og påvist for ikke klarcellet nyrecellekarsinomer [15] samt andre linjes behandling[16].
Immunterapi av metastatisk nyrecellekreft
Inntil for 10 år siden var det få pasienter som hadde effekt av medikamentell behandling som da var begrenset til immunterapi med interferon eller interleukin-2. Målrettet behandling for metastatisk nyrecellekreft har økt median overlevelsen for pasienter i alle risikogrupper; dette observeres også på befolkningsnivå.[17](36). Målrettet behandling har derfor i dag erstattet interferon eller interleukin-2 basert immunterapi.
Historisk har enkelte pasienter (klarcellet RCC i god prognose gruppe, ung alder og god allmenntilstand) respondert svært bra på behandling med IL-2 i kombinasjon med IFN og oppnådd langtids overlevelse[18]. Den viktigste erfaring med IL-2 basert immunterapi ved metastatisk RCC er at varig, komplett respons er mulig ved hjelp av en immunologisk behandling.
Nye data fra fase 1 og 2 studier har vist lovende resultater ved bruk av immuncheckpoint-inhibitorer med blokkering av PD-1/ L1 komplekset[19] [20]. Monoterapi med PD-1- antistoffet nivolumab har i disse studier vist relativt beskjedne respons rater (17, 20 og 29 %), men majoriteten av responsene er langvarige (opp til 22 måneder), og med median OS mellom 18 og 25 måneder (endepunkt enda ikke nådd i enkelte studier). Dertil hadde ca. 60 % av pasientene inkludert i disse studier klinisk effekt av behandlingen dersom man også medregner stabil sykdom[20]. Man venter nå på data fra en ferdig inkludert fase 3 studie med nivolumab vs. everolimus i 2./3. linje som forhåpentligvis vil bidra til økt forståelse av PD-1-blokkade ved nyrecellekreft og avklare en potensiell overlevelsesgevinst.
Andre viktige og lovende studier er kombinasjoner med PD-1/PD-L1 hemmere og TKI samt dobbel immunblokkade med anti-CTLA-4. Aktuelt gjennomføres en fase III studie med nivolumab og ipilimumab versus sunitinib som 1.linjes behandling ved metastatisk nyrecellekreft hvor inklusjonen forventes avsluttet ved utgangen av 2015. Nivolumab i kombinasjon med sunitinib og pazopanib har i fase 1 og fase 2 studier vist imponerende respons rater (43-52 %), men med betydelig mer toksisitet enn ved mono-terapi. Den optimale timingen av disse legemidler, respons kinetikken og bruken av respons kriterier er viktige spørsmål som diskuteres og som søkes avklart i pågående studier.
Samlet er den immunologiske behandling av nyrecellekreft i rask utvikling.
Sekvensiell målrettet behandling
Virkningsmekanismen av de målrettede nye legemidler er hemming av angiogenese. Sunitinib, pazopanib, axitinib og sorafenib hemmer multiple reseptortyrosinkinaser inkludert vaskulær endotelial vekstfaktor (VEGF) reseptor (VEGFR hemmere). Bevacizumab er en monoklonal antistoff rettet mot VEGF. Temsirolimus og everolimus hemmer mTOR-kompleks -1 og virker både direkte antiproliferativ og antivaskulær (mTOR hemmere).
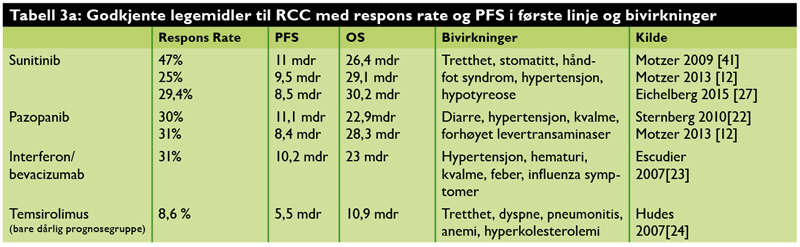
Fire substanser har indikasjon for første linjes behandling. Både pazopanib og sunitinib har sammenlignbar effekt i første linje (tabell 2, 3a), men noe ulik bivirkningsprofil. Bevacizumab + interferon er godkjent for behandling i første linje; kombinasjonen er vesentlig dyrere enn pazopanib og sunitinib uten å være bedre, og brukes lite i Norge. Everolimus har ingen plass i første linjes behandling av klarcellet nyrecellekarsinom[29]. Temsirolimus har bare godkjenning som første linje behandling til pasienter i dårlig prognose gruppe. I Norge brukes Temsirolimus lite av praktiske hensyn (ukentlig intravenøs behandling, lange reiseveier)[21]. Beste respons er som hovedregel partiell respons hvor komplette responser forkommer særdeles sjelden.
Tre preparater har godkjenning for behandling i andre linje etter primær antivaskulær behandling (tabell 3b). I en fase III undersøkelse av temsirolimus versus sorafenib etter progresjon på sunitinib ble det sett signifikant forbedret overlevelse hos pasienter behandlet med sorafenib (16,6 mdr. vs. 12,3 mdr.[26]. Denne studien støtter sekvensiell VEGF hemmer behandling. Mange studier har vist at pasienter som gjennomfører mer enn en linje med målrettet behandling har bedre overlevelse. Pasienter som progredierer på første linje og som er i god allmenntilstand, bør derfor fortsette med andre linjes behandling. Rekkefølgen av substansene er sannsynligvis mindre viktig enn antall behandlingslinjer men dette er et mye diskutert spørsmål[27, 28].
Selv om en kombinasjon av legemidler i teorien kan minimere utvikling av resistens ved multippel synkron signal blokade, har toksisiteten stoppet slike forsøk i praksis[28].
De store studiene har primært inkludert pasienter med klarcellet histologi, dokumentasjon for pasienter med ikke-klarcellet histologi er mer sparsom og behandlingsanbefalingene preges av større usikkerhet. For et fåtall spesielt aggressive subtyper (translokasjon, samlegangs cancer, høy andel sarcomatoid utdifferensering) kan kombinasjonskjemoterapi med for eksempel gemcitabin+doxorubicin i første eller andre linje være indisert.[30-32]. Men også de fleste nyrecellekarcinomer med ikke klarcellet histologi behandles best med en VEGF hemmer. På ASCO 2015 ble det presentert fase II data (ASPEN) med everolimus vs. sunitinib til pasienter med ikke-klarcellet RCC (37). Overordnet hadde pasienter behandlet med sunitinib bedre progresjonsfri overlevelse (8,3 vs. 5,6 mdr.) og bedre total overlevelse (32 vs. 13 mdr.). Subgruppeanalyser viste imidlertid at patienter i MSKCC dårlig prognose gruppe og pasienter med kromofob nyrecellekarsinom hadde bedre effekt av everolimus. Disse data understreker at ikke-klarcellet RCC er en inhomogen gruppe sammensatt av forskjellige sykdommer som trolig skal behandles forskjellig. Studier vedrørende ikke-klarcellet RCC er derfor høyt prioritet.
Benstyrkende behandling
Behandling med zoledronsyre bør overveies til pasienter med utbredt skjelettmetastasering. Behandling med zoledronsyre har vist reduksjon av skjelett relaterte hendelser med 61% i forhold til placebo[33]. Behandling med zoledronsyre 4 mg i.v. (evt. doseredusert ved nyresvikt) kan gis hver 4- 6.uke og dermed koordineres med pasientens øvrige besøk (38).
Den mest fryktede bivirkning er kjeve-nekrose, og risikoen, især ved kombinasjon med sunitinib, kan se ut til å være noe større for nyrecellekreft pasienter enn ved andre indikasjoner [34][38]. Tannsanering før behandlingsstart og regelmessige tannlegekontroller anbefales derfor. Zoledronsyre bør overveies brukt i kombinasjon med andre VEGF hemmere enn sunitinib.
Konklusjon
Målrettet behandling med VEGFR- og mTOR hemmere har forbedret prognosen for pasienter med metastatisk klarcellet nyrecellekreft. Prognostiske systemer (IMDC eller MSKCC) er viktige hjelpemidler i den kliniske hverdagen.
Sekvensiell behandling er effektivt. Bivirkningsprofil kan veilede valg av preparatene.
Dødeligheten er dessverre fortsatt høy for primært resistente nyrecellekreft pasienter i dårlig prognosegruppe og pasienter med spesielle histologiske subtyper.
Immunterapien vil trolig få en mer sentral plass i behandlingen av nyrecellekreft. Tidlige studier med immuncheckpoint inhibitorer med anti PD-L / L1 og kombinasjoner med TKI og anti-CTLA-4 har vist lovende resultater. Men data er enda ikke modne for endelig tolkning og mye gjenstår før disse legemidler kan inkorporeres i behandlingsalgoritmen.
Referanser
1. Cancer in Norway 2013 – Cancer incidence, mortality, survival and prevalence in Norway.
Oslo: Cancer Registry of Norway, 2015
2. EAU Guidelines on Renal Cell Carcinoma: 2014 Update. European Urology, 2015. 67(5): p. 913.
3. Alvarez, A.L., A phase II study of pazopanib (P) in patients (Pts) with localized renal cell carcinoma (RCC) to enable partial nephrectomy (PN). Journal of Clinical Oncology, 2014. 32:5s(suppl; abstr 4522).
4. Karam, J.A., et al., Phase 2 trial of neoadjuvant axitinib in patients with locally advanced nonmetastatic clear cell renal cell carcinoma. Eur Urol, 2014. 66(5): p. 874-80.
5. Rini, B.I., et al., The effect of sunitinib on primary renal cell carcinoma and facilitation of subsequent surgery. J Urol, 2012. 187(5): p 1548-54.
6. Clinical Trial to Assess the Importance of Nephrectomy (CARMENA).
7. Immediate Surgery or Surgery After Sunitinib Malate in Treating Patients With Metastatic Kidney Cancer (SURTIME). Available from: https://clinicaltrials.gov/ct2/show/NCT01099423.
8. Heng, D.Y., et al., Cytoreductive nephrectomy in patients with synchronous metastases from renal cell carcinoma: results from the International Metastatic Renal Cell Carcinoma Database Consortium. Eur Urol, 2014. 66(4): p. 704-10.
9. Dabestani, S., et al., Local treatments for metastases of renal cell carcinoma: a systematic review. Lancet Oncol, 2014. 15(12): p. e549-61.
10. Heng, D.Y., et al., Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol, 2009. 27(34): p. 5794-9.
11. Motzer, R.J., et al., Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol, 1999. 17(8): p. 2530-40.
12. Motzer, R.J., et al., overall survival in renal-cell carcinoma with pazopanib versus sunitinib. N Engl J Med, 2014. 370(18): p. 1769-70.
13. Heng, D.Y., et al., External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol, 2013. 14(2): p. 141-8.
14. Harshman, L.C., et al., Conditional survival of patients with metastatic renal-cell carcinoma treated with VEGF-targeted therapy: a population-based study. Lancet Oncol, 2012. 13(9): p. 927-35.
15. Kroeger, N., et al., Metastatic non-clear cell renal cell carcinoma treated with targeted therapy agents: characterization of survival outcome and application of the International mRCC Database Consortium criteria. Cancer, 2013. 119(16): p. 2999-3006.
16. Ko, J.J., et al., The International Metastatic Renal Cell Carcinoma Database Consortium model as a prognostic tool in patients with metastatic renal cell carcinoma previously treated with first-line targeted therapy: a population-based study. Lancet Oncol, 2015. 16(3): p. 293-300.
17. Soerensen, A.V., et al., Improved overall survival after implementation of targeted therapy for patients with metastatic renal cell carcinoma: results from the Danish Renal Cancer Group (DARENCA) study-2. Eur J Cancer, 2014. 50(3): p. 553-62.
18. Donskov, F. et von der Maase, H., impact of immune parameters on long-term survival in metastatic renal cell carcinoma. J Clin Oncol, 2006. 24(13): p. 1997-2007.
19. Motzer, R.J., et al., Nivolumab for Metastatic Renal Cell Carcinoma: Results of a Randomized Phase II Trial. J Clin Oncol, 2015. 33(13): p. 1430-7.
20. Harshman, L.C., C.G. Drake, and T.K. Choueiri, PD-1 blockade in renal cell carcinoma: to equilibrium and beyond. Cancer Immunol Res, 2014. 2(12): p. 1132-41.
21. Beisland, C., Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av nyrecellekreft. 2012, Helsedirektoratet: Oslo.
22. Sternberg, C.N., et al., Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol, 2010. 28(6): p. 1061-8.
23. Escudier, B., et al., Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet, 2007. 370(9605): p. 2103-11.
24. Hudes, G., et al., Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med, 2007. 356(22): p. 2271-81
25. Motzer, R.J., et al., Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet, 2008. 372(9637): p. 449-56.
26. Hutson, T.E., et al., Randomized phase III trial of temsirolimus versus sorafenib as second-line therapy after sunitinib in patients with metastatic renal cell carcinoma. J Clin Oncol, 2014. 32(8): p. 760-7.
27. Eichelberg,C., et al., SWITCH: A Randomised, Sequential, Open-label Study to Evaluate the Efficacy and Safety of Sorafenib-sunitinib Versus Sunitinib-sorafenib in the Treatment of Metastatic Renal Cell Cancer. Eur Urol. 2015 May 4. pii: S0302-2838
28. Albiges, L., et al., A Systematic Review of Sequencing and Combinations of Systemic Therapy in Metastatic Renal Cancer. European Urology, 2015. 67(1): p. 100-110.
29. Motzer, R.J., et al., Phase II randomized trial comparing sequential first-line everolimus and second-line sunitinib versus first-line sunitinib and second-line everolimus in patients with metastatic renal cell carcinoma. J Clin Oncol, 2014. 32(25): p. 2765-72.
30. Chowdhury, S., et al., Systemic therapy for metastatic non-clear-cell renal cell carcinoma: recent progress and future directions. Hematol Oncol Clin North Am, 2011. 25(4): p. 853-69.
31. Oudard, S., et al., Prospective multicenter phase II study of gemcitabine plus platinum salt for metastatic collecting duct carcinoma: results of a GETUG (Groupe d’Etudes des Tumeurs Uro-Genitales) study. J Urol, 2007. 177(5): p. 1698-702.
32. Shuch, B., et al., Targeting the mTOR pathway in Chromophobe Kidney Cancer. J Cancer, 2012. 3: p. 152-7.
33. Lipton, A., M. Zheng, and J. Seaman, Zoledronic acid delays the onset of skeletal-related events and progression of skeletal disease in patients with advanced renal cell carcinoma. Cancer, 2003. 98(5): p. 962-9.
34. Fusco, V., et al., Osteonecrosis of the Jaw in Patients With Metastatic Renal Cell Cancer Treated With Bisphosphonates and Targeted Agents: Results of an Italian Multicenter Study and Review of the Literature. Clin Genitourin Cancer, 2014.
35. Haas, N., et al., Initial results from ASSURE (E2805): Adjuvant sorafenib or sunitinib for unfavorable renal carcinoma, an ECOG-ACRIN-led, NCTN phase III trial. Presentert på ASCU-GU 2015, abstract nr. 403.
36. Klepp, O., et al., Overall survival in renal cell carcinoma before and after introsuction og targeted therapies: A Norwegian population based study (2002-2011). Presentert på ASCO-GU 2015, abstract 443.
37. Armstrong, A., final clinical results of a randomized phase II international trial of everolimus versus sunitinib in non-clearcell carcinoma (ASPEN). Presentert på ASCO 2015, abstract 4507.
38. Smidt-Hansen, T., et al., Combination of zoledronic Acid and targeted therapy is active but may induce osteonecrosis of the jaw in patients with metastatic renal cell carcinoma. J Oral Maxillofac Surg, 2013. 71(9): p. 1532-40.
39. Motzer, R.J., et al., Axitinib versus sorafenib as second-line treatment for advanced renal cell carcinoma: overall survival analysis and updated results from a randomised phase 3 trial. Lancet Oncol, 2013. 14(6): p. 552-62.
40. Motzer, R.J., et al., Phase 3 Trial of everolimus for metastatic renal cell carcinoma. Cancer, 2010. 116(18): p 4256-65.
41. Motzer, R.J., et al., Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol, 2009. 27(22): p.3584-90.