Hovedartikler

Kurativ strålebehandling ved prostatacancer
Av Wolfgang Lilleby1 og Arne Solberg2
1 Overlege dr.med., Kreftklnikk, OUS-Radiumhospitalet, Oslo
2 Overlege Ph.d., Avdelingssjef-leger, Kreftklinikken, St. Olavs Hospital, Universitetssykehuset i Trondheim
Epidemiologi
Hvert år diagnostiseres om lag 5000 nye tilfeller og det dør cirka 1000 menn årlig av prostatacancer (PCa) i Norge. Det store
flertallet av disse diagnostiseres med sykdommen i potensielt kurabelt stadium, og nesten 42.000 nordmenn lever med påvist prostatacancer [1].
Kurativ strålebehandling mot primærtumor
Strålebehandling med kurativ hensikt (radikal stråleterapi) kan tilbys til pasienter med lokalisert og lokalavansert PCa. Radikal strålebehandling kan gis med ekstern teknikk, som brachyterapi eller ved å kombinere disse teknikkene. Ekstern stråleterapi foregår poliklinisk, vanligvis gis mellom 37-39 fraksjoner á 2Gy (konvensjonell fraksjonering) over en periode på ca. åtte uker. Behandlingstiden ved kombinasjon av brachyterapi og ekstern strålebehandling er noe kortere (syv uker).
Risiko for tilbakefall etter radikal stråleterapi er relatert til primærtumors utbredelse (T-stadium), prostata-spesifikt antigen (PSA) nivå i serum og histopatologisk tumor grad (Gleason skår). Basert på disse faktorene klassifiseres pasientene i tre prognostiske risikogrupper ([2] tabell 1). Denne risikostratifiseringen kan ha betydning for størrelse av bestrålt tumor- og friskvevvolum, stråledose, teknikk og varighet av endokrin tilleggsbehandling.
Lav doserate brachyterapi (LDR-BT) i monoterapi med implantasjon av permanente kortrekkevide strålekilder (Jod-125 «seeds») i prostata praktiseres i de fleste vestlige land for lokaliserte svulster, men er ikke tilgjengelig i Norge. Høy dose-rate brachyterapi (HDR-BT) med kortvarig implantasjon av strålekilde (iridium-192) etterfulgt av ekstern strålebehandling mot prostata, vesikula seminalis og eventuelt bekkenlymfeknuter er tilgjengelig ved OUS-Radiumhospitalet i Norge for pasienter i intermediær og høy risikogruppe.
Ytterligere teknologiske nyvinninger som intensitetsmodulert stråleterapi (IMRT)/Volumetric Arc Therapy (VMAT), markør-rettet bildestyrt behandling (IGRT) og kombinasjoner av disse har fått utbredt anvendelse (Tabell 1). Så langt er imidlertid fordelene ved disse teknikkene ikke godt dokumentert i randomiserte studier.
Ekstern stråleterapi
Dose-effekt forhold
Det har aldri vært gjennomført en direkte sammenligning av kirurgi mot strålebehandling. Internasjonale og nasjonale retningslinjer anbefaler radikal stråleterapi ved lokalisert PCa og lokalavansert PCa på lik linje med radikal prostatektomi [3;4]. Flere randomiserte studier dokumenterer imidlertid at kombinert radikal ekstern strålebehandling med totaldose 70Gy og hormonbehandling, s. k. androgen deprivasjonsterapi (ADT), gir bedre totaloverlevelse enn hormonbehandling alene hos pasienter i intermediær- og høy risikogruppe [5-8].
Videre foreligger flere studier som indikerer nytte av doseeskalert ekstern strålebehandling (total stråledose > 74Gy) til pasienter i intermediær- og høyrisiko gruppen. Redusert andel med biopsiverifisert residualtumor som følge av doseeskalering ble påvist allerede på 1990-tallet [9]. Dette dose-respons forholdet ble senere verifisert i form av redusert biokjemisk residiv som følge av doseeskalert ekstern strålebehandling i flere randomiserte studier [10-12]. En av disse studiene indikerer også bedret overlevelse [13]. Metaanalyse med individuelle pasientdata fra disse studiene bekrefter reduksjon av residiv, men påviser ikke effekt på overlevelse som følge av doseeskalering [14]. Bivirkningene av doseeskalert behandling er imidlertid akseptable, og i Norge gis vanligvis totaldose tilsvarende ca. 78Gy med konvensjonell fraksjonering ved ekstern strålebehandling i intermediær- og høy risikogruppe.
Høydoserate Brachyterapi
Ved HDR-BT utnytter man optimal geometri i henhold til invers avstandsloven i kvadrat for dosefall, og strålefysiske isodosekunnskap i behandlingen av menn med PCa. Denne teknikken åpner derfor for å gi høy dose mot tumor og samtidig spare friske strukturer (urethra, rektum, nerver). Det avsettes på kort tid høye akkumulerte stråledoser (radiation accumulation dose, RAD) som kan være gunstig ved behandling av svulster med en lav alfa/beta ratio. Dessuten kan en forkortet strålebehandlingstid (seks til syv uker) bidra til å motvirke repopulasjon, noe som antagelig er undervurdert ved PCa [15]. Pasienter med stort kjertelvolum behandles med 3-6 måneder neo-adjuvant ADT for «downsizing» av målvolumet.
Ulempen med HDR-BT er narkose, enten profololrus eller spinalanestesi, og noen relative kontraindikasjoner (prostatavolum >60cc, TUR-P kavitet, trangt bekken (pubis arc interference). Monoterapi HDR-BT anses som utprøvende ved lokalisert PCa, men det foreligger oppløftende resultater hos egne enkeltpasienter og i større utenlandske serier [16]. HDR-BT monoterapi kan også være et godt alternativ ved absolutte eller relative kontraindikasjoner mot ekstern bestråling, eksempelvis hos pasienter med inflammatoriske tarmlidelser eller ved tidligere strålebehandling mot bekkenregionen.
Hypofraksjonert ekstern strålebehandling
Selv om bivirkningene gjennomgående er akseptable ses en økning i strålerelaterte bivirkninger ved stråledoser større enn
74 Gy gitt med 2 Gy fraksjoner. Det foregår en intens debatt om hypofraksjonering (biologisk tilsvarende eller høyere totaldose gitt med høyere fraksjonsdose over kortere tid) er mer egnet for prostatacancer enn det som betraktes som dagens standard (2 Gy fraksjoner) fordi flere studier indikerer at alfa/beta-ratio for PCa er lav (1.5 Gy) [17]. I så fall forventer man at en høyere fraksjonsdose vil være gunstig med tanke på stråleeffekt og langtidsskader. Det pågår flere randomiserte studier [18;19], men man må avvente langtidsresultater både hva gjelder effekt på overlevelse og bivirkninger før man kan trygt anbefale hypofraksjonering som standardbehandling.
For mer presis stråleavsetting implanteres ofte gullkorn i prostata. Disse «kornene» kan framstilles under feltkontrollavbilding, Cone-beam CT. Det testes ut nye metoder med GPS-lignende «tracking og gating» systemer eller transperineal ultralyd (Clarity) som framstiller prostata under hele stråleseansen. Slike metoder vil øke presisjon i selve strålebehandlingen og gi mulighet for ekstrem hypofraksjonering (>5Gy per fraksjon, bilde).
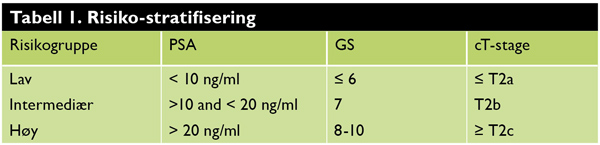
Lavrisiko: Alle prognostiske kriterier til stede 5 års biokjemisk kontroll rate 90%. Intermediær risiko: Minimum ett kriterium til stede 5 års biokjemisk kontrollrate 80% . Høyrisiko: Minimum ett kriterium til stede 5 års biokjemisk kontrollrate 70%.
Toksisitet
Ekstern stråleterapi
Konformal strålebehandling med moderne CT-basert doseplanlegging har vist bedre langtidsutfall og mindre toksisitet enn konvensjonell fire-felt boksteknikk [20]. Akutte strålebivirkninger oppstår underveis og mot slutten av behandlingen. Plagene kan vedvare noen uker, men er oftest selv-limiterende. Disse akutte strålereaksjoner rammer først og fremst raskt proliferende vev, altså mucosa i rektum og urinveier. Symptombildet domineres av sårhet i endetarmen og rundt anus samt dysuri og pollakisuri. Enkelte pasienter utvikler urinretensjon.
Tenesmer og diare indikerer stråleskade i tynntarm, hyppig avføringingstrang taler for affeksjon av øvre rektum. Videre indikerer frisk rektalblødning skade av rektumslimhinnen, og skade av analkanal/sphinkter kan gi fekal inkontinens. Symptomer på senskader kan melde seg flere år etter strålebehandlingen med urinlekkasje, urinretensjon og potenssvikt. Varige plager fra rektum etter radikal strålebehandling (kronisk stråleproktitt) forekommer hos 5-10% [21]. Pasienter med makroskopisk hematuri eller blødning fra rektum bør henvises raskt til utredning med cystoskopi eller rektoskopi, ikke minst for å utelukke annen alvorlig årsak til blødningen. Som tiltak mot stråleproktitt og/eller cystitt kan hyperbar oksygenbehandling i trykkammer vurderes [22;23]. Kronisk stråleindusert rektalblødning kan behandles med argonlaser koagulasjon[24].
Sekundærcancer er en sjelden men fryktet strålerelatert senbivirkning. I en Canadisk populasjonsbasert cohort-studie av nær 18000 menn behandlet med radikal prostatektomi eller EBRT fant man signifikat økt risiko for blære- rectum- og lungecancer hos bestrålte pasienter [25].
Ekstern hypofraksjonert behandling
Publiserte tall fra flere studiesenter tyder på at hypofraksjonert stråleterapi øker både akutte moderate bivirkninger [26] og gastrointestinale problemer ved lengre oppfølging [27] sammenlignet med bestråling med konvensjonell fraksjonsdose. Dette dreier seg stort sett om menn behandlet for lokalisert PCa i lav eller intermediær risikogruppe, og man må avvente resultat av pågående studier før men konkluderer vedrørende senbivirkninger av hypofraksjonert ekstern strålebehandling for lokalisert og lokalavansert PCa [28].
Brachyterapi
Det rapporteres om få langtidsbivirkninger etter LDR-BT når det gjelder ereksjonsevne og urin inkontinens [29;30] sammenlignet med ekstern strålebehandling med bruk av IMRT. En annen studie rapporterte grad 2 bivirkninger fra endetarm hos 1.4% av pasientene etter LDR-BT mot 5.1% etter ekstern bestråling [31] men høyere andel grad 2 akutte bivirkninger fra urinveiene i LDR-BT gruppen (15.6% vs. 4.3%).
Norske erfaringer vedrørende langtidsbivirkninger ved HDR-BT peker i samme retning [32;33]. Det ses få grad 2 senbivirkninger både fra endetarmen (7%) og urinveiene (9.5%) ved bruk av HDR-BT som boostteknikk kombinert med konformal ekstern strålebehandling (50 Gy/25 fraksjoner).
En hollandsk studie av sekundærcancer cancer i urinblære og rektum hos prostatacancer pasienter behandlet med LDR-BT og radikal prostatektomi viste ingen forskjell i insidens mellom behandlingsgruppene. Studiepopulasjonen hadde heller ikke høyere insidens av blære- eller rektumcancer enn den generelle befolkningen [34].
Bestråling av regionale lymfeknuter
Bekkenfelt pN0/cN0
Den optimale behandlingen av pasienter med lokalavansert PCa (T3-T4 tumor, Gleason skår 8-10, PSA over 20ng/mL, pN0-cN0M0) er omdiskutert [35;36]. Høyrisikogruppen er heterogen, og en stor andel av pasienter med flere høyrisikokriterier har okkulte metastaser. I flere av de randomiste studier som ligger til grunn for dagens praksis (radikal strålebehandling kombinert med langvarig ADT) ble det gitt profylaktisk bestråling mot bekkenlymfeknutene rutinemessig (< 50Gy) til pasienter i høy risikogruppe [37]. Nytten av slik behandling er imidlertid ikke entydig dokumentert i randomiserte studier, og det er følgelig ikke konsensus om kriterier for når bekkenlymfeknutebestråling bør gis.
Bekkenfelt pN1/cN1
Internasjonale retningslinjer betrakter adjuvant ADT som standard behandling hos pasienter som får påvist regional lymfeknutespredning (pN1) i forbindelse med RP. Dette begrunnes med påvist bedret totaloverlevelse i en randomisert studie [38]. Det er uavklart om denne gruppen og pasienter med klinisk påvist regional spredning (cN1) har nytte av lokoregional strålebehandling. Anbefalingene trekker imidlertid i retning av at kurativ intendert behandling bør tilbys selekterte pasienter med lang forventet levetid [39]. I materiale fra Radiumhospitalet så man gunstige resultater for menn med mindre enn tre positive bekkenglandler (prostata-spesifikk overlevelse på 92% etter 5år), men det beskrives også langvarig nedsatt livskvalitet pga. fatigue (Lilleby et al. Acta Oncologica i press). En potensielt kurativ tilnærmingen hos pasienter med regionale lymfeknutemetastaser må være multimodal i form av radikal prostektomi eller kurativ strålebehandling rettet mot primærtumor, og bekkenlymfeknutebestråling i kombinasjon med langvarig ADT (http://uroweb.org/guideline/prostate-cancer/).
Ved bekkenlymfeknutebestråling vil tradisjonell 3-4 feltsteknikk («boksteknikk») innebære betydelig strålebelastning på tynntarmen. Moderne teknikker som IMRT/VMAT reduserer dette problemet vesentlig (Figur 1) og bør forutsetningsvis benyttes. Radiation Therapy Oncology Group (RTOG) har utarbeidet atlas med konsensusbaserte forslag til målvolumsinntegning ved en rekke kreftsykdommer, inkludert PCa. Anbefalingene er utarbeidet av høyt kompetente fagfolk innen stråleterapi kan være til stor nytte, eksempelvis hos pasienter som skal ha strålebehandling mot regionale bekkenlymfeknuter (https://www.rtog.org/CoreLab/ContouringAtlases.aspx).
Adjuvant og salvage strålebehandling etter radikal prostatektomi
Det foreligger tre randomiserte studier som indikerer nytte av adjuvant stråleterapi mot prostatalosjen (60-64Gy) ved lokalavansert (pT3) og/eller margin positiv (R1) tumor etter radikal prostatektomi i form av redusert andel residiv og bedret biokjemisk progresjonsfri overlevelse [40;41]. Studien med lengst oppfølging viser også en forlenget totaloverlevelse i favør av adjuvant stråleterapi [40]. Imidlertid vil en stor andel pasienter med R1 og/eller pT3 tumor og negativ postoperativ PSA ikke få residiv (forhold 8:1). En alternativ strategi er derfor ekspektans og salvage stråleterapi ved biokjemisk residiv før PSA overstiger 0,5 [42]. Inntil 50% av pasientene vil da være uten biokjemisk progresjon 6 år etter salvage strålebehandling. I disse retrospektive studiene ble stråledose < 66Gy benyttet. Andre retrospektive studier indikerer at det foreligger et dose-respons forhold også ved salvage strålebehandling og at totaldose 70 Gy gir færre residiv [43], men dette er omdiskutert. Det foreligger imidlertid ikke prospektive randomiserte studier som dokumenterer bedret totaloverlevelse som følge av salvage stråleterapi.
Endokrin tilleggsbehandling
Europeiske retningslinjer anbefaler ADT i tillegg til radikal stråleterapi i 4-6 måneder hos pasienter i intermediær- og i 2-3 år i høy risikogruppe hos pasienter uten påvist spredning (http://uroweb.org/guideline/prostate-cancer/). Grunnlaget for anbefalingene er flere randomiserte studier som viser bedret totaloverlevelse ved kombinert behandling sammenlignet med strålebehandling alene [37;44]. Behandlingen gis neoadjuvant (2-3 mnd), konkomittant og adjuvant, hvor varigheten av adjuvant behandling bestemmes av risikogruppe. ADT kan gis i form av kjemisk kastrasjon (LHRH-agonist), som perifer androgen-reseptor blokade (anti-androgen) eller som kombinasjoner av disse, total androgen blokade (TAB). Både type ADT og tidspunkt for oppstart varierer i de randomiserte studiene som ligger til grunn for den generelle anbefalingen av endokrin tilleggsbehandling. I klinisk praksis startes ofte kjemisk kastrasjon eller TAB initialt med overgang til anti-androgen behandling der langtidsbehandling er indisert. Kort- og langtidsbivirkningene av ADT er betydelige og inkluderer potenssvikt, metabolsk syndrom, hetetokter, osteoporose, kognitiv svikt, fatigue mm.
Tiden vil vise om kjemoterapi og nyere medikamenter som brukes ved metastatisk PCa har en plass som adjuvans til kurativt rettet lokalbehandling. Muligens vil også mer pasient-tilrettelagt behandling med bruk av mutasjonsanalyse og immun-terapi vil bli en del av den systemiske primærbehandlingen hos menn som mottar radikal strålebehandling for prostatacancer.
Pågående strålestudier for menn med prostatakreft i Norge
- SPCG 15 – Kirurgi eller strålebehandling ved lokal avansert prostatakreft- en åpen randomisert klinisk studie, SPCG15
Forskningsprosjektet har to hovedmål:
- Undersøke om primær kirurgibehandling gir like god eller bedre overlevelse.
- Undersøke hvilken av primærbehandlingene som påvirker livskvaliteten minst under de 10 første årene etter avsluttet behandling.
Det planlegges inklusjon av 1200 pasienter i løpet av en 3 års periode.
Studien vil ha 90% styrke til å påvise en signifikant forskjell på 2.5-4% antatt at akkumulert prostata-spesifikk dødelighet over 10 år vil ligge på 15% for standard armen (RAD).
- Salvage HDR-BT ved lokalisert tilbakefall etter primær radioterapi (Oslo Universitetssykehus)
Forskningsprosjektet har to hovedmål:
- Toksisitetsregistrering
- Undersøke om man kan oppnå varig sykdomskontroll ved bruk av HDR-BT.
Det planlegges inklusjon av 50 pasienter.
- RIC-studien (A Randomised two ventre trial on daily cone-beam IGRT vs. Standard weekly orthogonal IGRT in Curative radiotherapy for prostate cancer; St. Olavs Hospital, Ålesund Sykehus)
Randomisert studie som sammenligner ved 78Gy mot standard margin og matching mot ben ukentlig eller mot små felt gitt med IGRT med daglig match mot gullmarkører. Studien har inkludert ca 250 pasienter.
- Ved Haukeland Universitetssykehus pågår 3 fase II studier / kvalitets-forbedrende protokoller (Svein Inge Helle; personlig meddelelse)
- Postoperativ strålebehandling hos høyriskopasienter (T3 med ufri margin eller biokjemisk residiv eller TxN1) – Integrert boost VMAT 2-2,4Gy x 25 mot prostataseng og bekkenlymfeknuter (80 av 100 pasienter inkludert)
- Dose-painting basert på MR funn hos høysrikopasienter – VMAT integrert boost 2.9Gy x 25 mot tumor (MR-definert), 2.4 Gy x 25 mot «normalt prostatavev + basale vesicula seminalis» samt eventuelle metastasesuspekte lymfeknuter, 2 Gy x 25 mot bekkenfelt (100 av 200 inkludert).
- Re-behandling etter tidl. Stråling (MR + biopsiverifisert sykdom) – VMAT 7 Gy x 5 mot MR definert tumor (30 av 40 inkludert)
Referanser:
- Kreftregisteret. Kreftstatistikk for Norge i 2014. 2013. Ref Type: Report
- D’Amico AV, Moul J, Carroll PR, Sun L, Lubeck D, Chen MH: Cancer-specific mortality after surgery or radiation for patients with clinically localized prostate cancer managed during the prostate-specific antigen era. J Clin Oncol 1-6-2003;21:2163-2172.
- Heidenreich A, Bellmunt J, Bolla M, Joniau S, Mason M, Matveev V, Mottet N, Schmid HP, van der KT, Wiegel T, Zattoni F: [EAU guidelines on prostate cancer. Part I: screening, diagnosis, and treatment of clinically localised disease]. Actas Urol Esp 2011;35:501-514.
- Helsedirektoratet. Nasjonale retningslinjer, handlingsprogram for prostatakreft. 2013. Ref Type: Report
- Bolla M, Van TG, Warde P, Dubois JB, Mirimanoff RO, Storme G, Bernier J, Kuten A, Sternberg C, Billiet I, Torecilla JL, Pfeffer R, Cutajar CL, van der KT, Collette L: External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. Lancet Oncol 2010;11:1066-1073.
- Horwitz EM, Bae K, Hanks GE, Porter A, Grignon DJ, Brereton HD, Venkatesan V, Lawton CA, Rosenthal SA, Sandler HM, Shipley WU: Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 20-5-2008;26:2497-2504.
- Mason MD, Parulekar WR, Sydes MR, Brundage M, Kirkbride P, Gospodarowicz M, Cowan R, Kostashuk EC, Anderson J, Swanson G, Parmar MK, Hayter C, Jovic G, Hiltz A, Hetherington J, Sathya J, Barber JB, McKenzie M, El-Sharkawi S, Souhami L, Hardman PD, Chen BE, Warde P: Final Report of the Intergroup Randomized Study of Combined Androgen-Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer. J Clin Oncol 1-7-2015;33:2143-2150.
- Widmark A, Klepp O, Solberg A, Damber JE, Angelsen A, Fransson P, Lund JA, Tasdemir I, Hoyer M, Wiklund F, Fossa SD: Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 24-1-2009;373:301-308.
- Pollack A, Zagars GK, Smith LG, Lee JJ, von Eschenbach AC, Antolak JA, Starkschall G, Rosen I: Preliminary results of a randomized radiotherapy dose-escalation study comparing 70 Gy with 78 Gy for prostate cancer. J Clin Oncol 1-12-2000;18:3904-3911.
- Dearnaley DP, Sydes MR, Graham JD, Aird EG, Bottomley D, Cowan RA, Huddart RA, Jose CC, Matthews JH, Millar J, Moore AR, Morgan RC, Russell JM, Scrase CD, Stephens RJ, Syndikus I, Parmar MK: Escalated-dose versus standard-dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 2007;8:475-487.
- Kuban DA, Dong L: High-dose intensity modulated radiation therapy for prostate cancer. Curr Urol Rep 2004;5:197-202.
- Peeters ST, Heemsbergen WD, Koper PC, van Putten WL, Slot A, Dielwart MF, Bonfrer JM, Incrocci L, Lebesque JV: Dose-response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol 1-5-2006;24:1990-1996.
- Kuban DA, Levy LB, Cheung MR, Lee AK, Choi S, Frank S, Pollack A: Long-term failure patterns and survival in a randomized dose-escalation trial for prostate cancer. Who dies of disease? Int J Radiat Oncol Biol Phys 1-4-2011;79:1310-1317.
- Viani GA, Stefano EJ, Afonso SL: Higher-than-conventional radiation doses in localized prostate cancer treatment: a meta-analysis of randomized, controlled trials. Int J Radiat Oncol Biol Phys 1-8-2009;74:1405-1418.
- Baumann M, Holscher T, Denham J: Fractionation in prostate cancer–is it time after all? Radiother Oncol 2010;96:1-5.
- Kovacs G, Potter R, Loch T, Hammer J, Kolkman-Deurloo IK, de la Rosette JJ, Bertermann H: GEC/ESTRO-EAU recommendations on temporary brachytherapy using stepping sources for localised prostate cancer. Radiother Oncol 2005;74:137-148.
- Fowler JF, Ritter MA, Fenwick JD, Chappell RJ: How low is the alpha/beta ratio for prostate cancer? In regard to Wang et al., IJROBP 2003;55:194-203. Int J Radiat Oncol Biol Phys 1-10-2003;57:593-595.
- Aluwini S, Pos F, Schimmel E, van LE, Krol S, van der Toorn PP, de JH, Dirkx M, Alemayehu WG, Heijmen B, Incrocci L: Hypofractionated versus conventionally fractionated radiotherapy for patients with prostate cancer (HYPRO): acute toxicity results from a randomised non-inferiority phase 3 trial. Lancet Oncol 2015;16:274-283.
- Wilkins A, Mossop H, Syndikus I, Khoo V, Bloomfield D, Parker C, Logue J, Scrase C, Patterson H, Birtle A, Staffurth J, Malik Z, Panades M, Eswar C, Graham J, Russell M, Kirkbride P, O’Sullivan JM, Gao A, Cruickshank C, Griffin C, Dearnaley D, Hall E: Hypofractionated radiotherapy versus conventionally fractionated radiotherapy for patients with intermediate-risk localised prostate cancer: 2-year patient-reported outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 2015;16:1605-1616.
- Dearnaley DP, Khoo VS, Norman AR, Meyer L, Nahum A, Tait D, Yarnold J, Horwich A: Comparison of radiation side-effects of conformal and conventional radiotherapy in prostate cancer: a randomised trial. Lancet 23-1-1999;353:267-272.
- Stensvold A, Dahl AA, Brennhovd B, Smastuen MC, Fossa SD, Lilleby W, Steinsvik A, Axcrona K, Smeland S: Bother problems in prostate cancer patients after curative treatment. Urol Oncol 16-2-2012.
- Oliai C, Fisher B, Jani A, Wong M, Poli J, Brady LW, Komarnicky LT: Hyperbaric oxygen therapy for radiation-induced cystitis and proctitis. Int J Radiat Oncol Biol Phys 1-11-2012;84:733-740.
- Oliver SE, May MT, Gunnell D: International trends in prostate-cancer mortality in the ”PSA ERA”. Int J Cancer 15-6-2001;92:893-898.
- Yeoh E, Tam W, Schoeman M, Moore J, Thomas M, Botten R, Di MA: Argon plasma coagulation therapy versus topical formalin for intractable rectal bleeding and anorectal dysfunction after radiation therapy for prostate carcinoma. Int J Radiat Oncol Biol Phys 1-12-2013;87:954-959.
- Bhojani N, Capitanio U, Suardi N, Jeldres C, Isbarn H, Shariat SF, Graefen M, Arjane P, Duclos A, Lattouf JB, Saad F, Valiquette L, Montorsi F, Perrotte P, Karakiewicz PI: The rate of secondary malignancies after radical prostatectomy versus external beam radiation therapy for localized prostate cancer: a population-based study on 17,845 patients. Int J Radiat Oncol Biol Phys 1-2-2010;76:342-348.
- Arcangeli G, Fowler J, Gomellini S, Arcangeli S, Saracino B, Petrongari MG, Benassi M, Strigari L: Acute and late toxicity in a randomized trial of conventional versus hypofractionated three-dimensional conformal radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys 15-3-2011;79:1013-1021.
- Pollack A, Walker G, Horwitz EM, Price R, Feigenberg S, Konski AA, Stoyanova R, Movsas B, Greenberg RE, Uzzo RG, Ma C, Buyyounouski MK: Randomized trial of hypofractionated external-beam radiotherapy for prostate cancer. J Clin Oncol 1-11-2013;31:3860-3868.
- Wilkins A, Mossop H, Syndikus I, Khoo V, Bloomfield D, Parker C, Logue J, Scrase C, Patterson H, Birtle A, Staffurth J, Malik Z, Panades M, Eswar C, Graham J, Russell M, Kirkbride P, O’Sullivan JM, Gao A, Cruickshank C, Griffin C, Dearnaley D, Hall E: Hypofractionated radiotherapy versus conventionally fractionated radiotherapy for patients with intermediate-risk localised prostate cancer: 2-year patient-reported outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 2015;16:1605-1616.
- Buron C, Le VB, Cosset JM, Pommier P, Peiffert D, Delannes M, Flam T, Guerif S, Salem N, Chauveinc L, Livartowski A: Brachytherapy versus prostatectomy in localized prostate cancer: results of a French multicenter prospective medico-economic study. Int J Radiat Oncol Biol Phys 1-3-2007;67:812-822.
- Rodrigues G, Yao X, Loblaw DA, Brundage M, Chin JL: Low-dose rate brachytherapy for patients with low- or intermediate-risk prostate cancer: A systematic review. Can Urol Assoc J 2013;7:463-470.
- Zelefsky MJ, Yamada Y, Pei X, Hunt M, Cohen G, Zhang Z, Zaider M: Comparison of tumor control and toxicity outcomes of high-dose intensity-modulated radiotherapy and brachytherapy for patients with favorable risk prostate cancer. Urology 2011;77:986-990.
- Lilleby W, Tafjord G, Raabe NK: Implementation of high-dose-rate brachytherapy and androgen deprivation in patients with prostate cancer. Int J Radiat Oncol Biol Phys 1-7-2012;83:933-939.
- Raabe NK, Lilleby W, Tafjord G, Astrom L: [High dose rate brachytherapy in prostate cancer in Norway]. Tidsskr Nor Laegeforen 29-5-2008;128:1275-1278.
- Hinnen KA, Schaapveld M, van VM, Battermann JJ, van der PH, van O, I, van Roermund JG, Monninkhof EM: Prostate brachytherapy and second primary cancer risk: a competitive risk analysis. J Clin Oncol 1-12-2011;29:4510-4515.
- Pommier P, Chabaud S, Lagrange JL, Richaud P, Lesaunier F, Le PE, Wagner JP, Hay MH, Beckendorf V, Suchaud JP, Pabot du Chatelard PM, Bernier V, Voirin N, Perol D, Carrie C: Is there a role for pelvic irradiation in localized prostate adenocarcinoma? Preliminary results of GETUG-01. J Clin Oncol 1-12-2007;25:5366-5373.
- Roach M, III, DeSilvio M, Lawton C, Uhl V, Machtay M, Seider MJ, Rotman M, Jones C, Asbell SO, Valicenti RK, Han S, Thomas CR, Jr., Shipley WS: Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 15-5-2003;21:1904-1911.
- Bolla M, Gonzalez D, Warde P, Dubois JB, Mirimanoff RO, Storme G, Bernier J, Kuten A, Sternberg C, Gil T, Collette L, Pierart M: Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. N Engl J Med 31-7-1997;337:295-300.
- Messing EM, Manola J, Sarosdy M, Wilding G, Crawford ED, Trump D: Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 9-12-1999;341:1781-1788.
- Lilleby W, Narrang A, Tafjord G, Vlatkovic L, Russnes KM, Stensvold A, Hole KH, Tran P, Eilertsen K: Favorable outcomes in locally advanced and node positive prostate cancer patients treated with combined pelvic IMRT and androgen deprivation therapy. Radiat Oncol 2015;10:232.
- Thompson IM, Tangen CM, Paradelo J, Lucia MS, Miller G, Troyer D, Messing E, Forman J, Chin J, Swanson G, Canby-Hagino E, Crawford ED. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol. 2009 Mar;181(3):956-62.
- Van der Kwast TH, Bolla M, van PH, Van CP, Vekemans K, Da PL, Bosset JF, Kurth KH, Schroder FH, Collette L: Identification of patients with prostate cancer who benefit from immediate postoperative radiotherapy: EORTC 22911. J Clin Oncol 20-9-2007;25:4178-4186.
- Stephenson AJ, Bolla M, Briganti A, Cozzarini C, Moul JW, Roach M, III, van PH, Zietman A: Postoperative radiation therapy for pathologically advanced prostate cancer after radical prostatectomy. Eur Urol 2012;61:443-451.
- Goenka A, Magsanoc JM, Pei X, Schechter M, Kollmeier M, Cox B, Scardino PT, Eastham JA, Zelefsky MJ: Long-term outcomes after high-dose postprostatectomy salvage radiation treatment. Int J Radiat Oncol Biol Phys 1-9-2012;84:112-118.
- D’Amico AV, Chen MH, Renshaw AA, Loffredo M, Kantoff PW: Androgen suppression and radiation vs radiation alone for prostate cancer: a randomized trial. JAMA 23-1-2008;299:289-295.

